题目内容
(2013?锦州)某化学课堂上同学们正在进行酸、碱、盐知识的探究,以下是教学片断,请你参与其中并认真填写空格.
【学生实验】将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
【学生板演】澄清石灰水变浑浊的原理
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应
【实验探究】
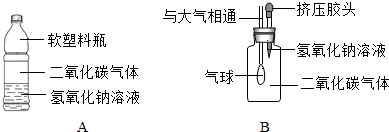
(1)小华设计了如图所示的A、B两个实验.
实验现象:A中软塑料瓶変瘪,B中
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低.小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是
(3)小宁设计的是通过检验生成物来验证猜想,请帮她填写实验报告.
【实验结论】二氧化碳和氢氧化钠溶液发生了反应.
【反思拓展】通过此探究实验,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是

【学生实验】将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
【学生板演】澄清石灰水变浑浊的原理
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
(用化学方程式表示)【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应
【实验探究】
(1)小华设计了如图所示的A、B两个实验.
实验现象:A中软塑料瓶変瘪,B中
气球膨胀变大(合理说法均可)
气球膨胀变大(合理说法均可)
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低.小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是
二氧化碳能与水反应,也能使容器内压强降低
二氧化碳能与水反应,也能使容器内压强降低
,要得到科学严谨的结论,仍利用该装置,补做的对比实验是将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比
将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比
.(3)小宁设计的是通过检验生成物来验证猜想,请帮她填写实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 向B实验后的溶液中加入 稀盐酸(或氯化钙溶液等) 稀盐酸(或氯化钙溶液等) |
有气泡产生(或有白色沉淀生成等) 有气泡产生(或有白色沉淀生成等) |
验证了二氧化碳和氢氧化钠溶液反应 |
【反思拓展】通过此探究实验,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是
可以通过检验反应物减少证明反应发生
可以通过检验反应物减少证明反应发生
;可以通过检验生成物证明反应发生
可以通过检验生成物证明反应发生
.分析:【学生板演】据二氧化碳与澄清石灰水的主要成分氢氧化钙反应原理书写方程式;
【实验探究】(1)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,瓶内气压减小,大气压将空气压入气球,气球变大;
(2)根据二氧化碳能与水反应,也能使容器内压强减小,所以还需设计将氢氧化钠溶液换成等体积的水,再重复实验与放入氢氧化钠溶液的现象进行对比从而推导结论;
(3)证明二氧化碳与氢氧化钠溶液发生反应,还可以检验其反应生成物来验证,碳酸钠可与酸反应生成气体,与可溶性的钙盐、钡盐反应生成沉淀,与氢氧化钙溶液、氢氧化钡溶液反应生成沉淀,据此设计实验;
【反思拓展】通过以上实验设计分析证明反应的发生的可行实验途径.
【实验探究】(1)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,瓶内气压减小,大气压将空气压入气球,气球变大;
(2)根据二氧化碳能与水反应,也能使容器内压强减小,所以还需设计将氢氧化钠溶液换成等体积的水,再重复实验与放入氢氧化钠溶液的现象进行对比从而推导结论;
(3)证明二氧化碳与氢氧化钠溶液发生反应,还可以检验其反应生成物来验证,碳酸钠可与酸反应生成气体,与可溶性的钙盐、钡盐反应生成沉淀,与氢氧化钙溶液、氢氧化钡溶液反应生成沉淀,据此设计实验;
【反思拓展】通过以上实验设计分析证明反应的发生的可行实验途径.
解答:解:【学生板演】二氧化碳与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙沉淀和水,方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;
【实验探究】(1)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,瓶内气体减少,气压减小,大气压将空气压入气球,所以气球变大;
(2)二氧化碳能与水反应,也能使容器内气体减少,压强减小,所以小华的设计不严密;要验证二氧化碳与氢氧化钠溶液确实发生了反应,还需设计对比实验,将氢氧化钠溶液换成等体积的水,再重复实验与放入氢氧化钠溶液的现象(软塑料瓶变瘪的程度是否相同、气球膨胀的大小是否相同)通过对比推导出正确的结论;
(3)证明二氧化碳与氢氧化钠溶液发生反应,还可以检验其反应生成物来验证,可向实验后的溶液中滴加稀盐酸或氯化钙溶液,若观察到有气泡生成或白色沉淀生成,说明二者发生了反应,因为氢氧化钠与盐酸反应生成水,无气体生成,氢氧化钠与氯化钙溶液不反应;
【反思拓展】通过以上实验可以看出,对于没有明显现象的化学反应,我们可以通过间接检验反应物是否减少或检验生成物的方法验证反应是否发生;
故答案为:【学生板演】CO2+Ca(OH)2═CaCO3↓+H2O;
【实验探究】(1)气球膨胀变大(合理说法均可);
(2)二氧化碳能与水反应,也能使容器内压强降低;将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比;
(3)
【反思拓展】可以通过检验反应物减少证明反应发生;可以通过检验生成物证明反应发生.
【实验探究】(1)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,瓶内气体减少,气压减小,大气压将空气压入气球,所以气球变大;
(2)二氧化碳能与水反应,也能使容器内气体减少,压强减小,所以小华的设计不严密;要验证二氧化碳与氢氧化钠溶液确实发生了反应,还需设计对比实验,将氢氧化钠溶液换成等体积的水,再重复实验与放入氢氧化钠溶液的现象(软塑料瓶变瘪的程度是否相同、气球膨胀的大小是否相同)通过对比推导出正确的结论;
(3)证明二氧化碳与氢氧化钠溶液发生反应,还可以检验其反应生成物来验证,可向实验后的溶液中滴加稀盐酸或氯化钙溶液,若观察到有气泡生成或白色沉淀生成,说明二者发生了反应,因为氢氧化钠与盐酸反应生成水,无气体生成,氢氧化钠与氯化钙溶液不反应;
【反思拓展】通过以上实验可以看出,对于没有明显现象的化学反应,我们可以通过间接检验反应物是否减少或检验生成物的方法验证反应是否发生;
故答案为:【学生板演】CO2+Ca(OH)2═CaCO3↓+H2O;
【实验探究】(1)气球膨胀变大(合理说法均可);
(2)二氧化碳能与水反应,也能使容器内压强降低;将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比;
(3)
| 实验步骤 | 实验现象 | 实验结论 |
| 向B实验后的溶液中加入 稀盐酸(或氯化钙溶液等) |
有气泡产生(或有白色沉淀生成等) |
验证了二氧化碳和氢氧化钠溶液反应 |
点评:本题主要考查了常见的两种碱氢氧化钠、氢氧化钙的性质,以实验探究的形式考查了学生依据所学知识分析和解答问题的能力,以及设计实验、据实验现象推导结论的能力,能较好考查生对碱的知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?锦州一模)某学习小组在探究“酸的化学性质”时,做了如图所示的A、B两个实验.分别向氢氧化钠和碳酸钠溶液中加入一定质量的稀硫酸,反应结束后,把废液倒入同一个废液缸中,观察到废液缸中产生少量气泡.请回答下列问题:
(2013?锦州一模)某学习小组在探究“酸的化学性质”时,做了如图所示的A、B两个实验.分别向氢氧化钠和碳酸钠溶液中加入一定质量的稀硫酸,反应结束后,把废液倒入同一个废液缸中,观察到废液缸中产生少量气泡.请回答下列问题: (2013?锦州) (1)如图是硫元素在元素周期表中的相关信息和硫的原子结构示意图,请根据图中信息回答问题:
(2013?锦州) (1)如图是硫元素在元素周期表中的相关信息和硫的原子结构示意图,请根据图中信息回答问题: