题目内容
在化学实验室,某研究性学习小组发现了一个不和谐的音符,一瓶久置的氢氧化钠固体敞口露置在空气中,他们认为氢氧化钠固体可能变质了,为此他们展开了探究,请你参与.【查阅资料】Ba(NO3)2溶液呈中性,碳酸钠溶液呈碱性
【实验猜想】可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.
【实验探究】(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的Ba(NO3)2溶液,产生白色沉淀,静置后取上层清液,再滴入无色酚酞溶液,溶液变红色.根据实验现象,可确定该固体是
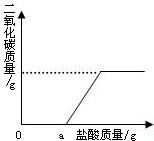
(2)再取固体样品溶于水,加入一定质量分数的稀硫酸,直至过量.测出加入稀硫酸的质量与产生CO2气体的质量关系如图所示.从图中可以判断:在该样品溶液中加入稀硫酸,首先与之反应的物质是
【实验分析】请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀硫酸反应,变质前消耗硫酸的质量
【综合计算】(1)称取26.5g 该固体样品于锥形瓶中,加入一定质量分数的稀硫酸,直至过量,得到数据如下表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 26.5克 | 148.5克 | 146.3克 |
(2)该固体样品中碳酸钠的质量分数是
分析:【实验探究】(1)若含有碳酸钠,加入硝酸钡溶液后会生成碳酸钡沉淀;当碳酸钠完全反应后,滴入酚酞试液仍变红,可说明溶液呈碱性,溶液中含有氢氧化钠;
(2)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,而图中曲线所示,开始加入稀硫酸时并没有气体产生,可判断此时硫酸没有和碳酸钠发生反应;
【实验分析】根据化学变化前后元素的质量不变,氢氧化钠变质生成碳酸钠时物质的质量增加,但其中所含钠元素的质量不变,则充分反应后生成硫酸钠的质量相等,可得知消耗稀硫酸的质量也相等;
【综合计算】(1)根据质量守恒定律,由反应前后质量差求出放出二氧化碳的质量;再根据反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钠的质量;
(2)利用该固体样品中碳酸钠的质量分数=
×100%,完成样品中碳酸钠的质量分数的计算.
(2)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,而图中曲线所示,开始加入稀硫酸时并没有气体产生,可判断此时硫酸没有和碳酸钠发生反应;
【实验分析】根据化学变化前后元素的质量不变,氢氧化钠变质生成碳酸钠时物质的质量增加,但其中所含钠元素的质量不变,则充分反应后生成硫酸钠的质量相等,可得知消耗稀硫酸的质量也相等;
【综合计算】(1)根据质量守恒定律,由反应前后质量差求出放出二氧化碳的质量;再根据反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钠的质量;
(2)利用该固体样品中碳酸钠的质量分数=
| 样品碳酸钠的质量 |
| 样品的质量26.5g |
解答:解:【实验探究】(1)样品的溶液能与Ba(NO3)2溶液,产生白色沉淀,说明溶液中含有碳酸钠,可判断氢氧化钠已经变质;与足量的Ba(NO3)2溶液反应后的溶液能使酚酞变红,说明反应后的溶液中含有氢氧化钠,可判断氢氧化钠部分变质;因此固体为NaOH和Na2CO3的混合物;
(2)根据加入稀硫酸的质量与产生CO2气体的质量关系图可知,在一开始加入稀硫酸时并没有气体产生,说明此时所加稀硫酸与氢氧化钠发生反应;
【实验分析】变质前后钠元素质量不变,所以与硫酸充分反应后生成的硫酸钠的质量一定相等,而相等的硫酸钠中硫酸根的质量相同,所以,变质前后所消耗稀硫酸的质量相等;
【综合计算】(1)根据质量质量守恒定律,反应放出二氧化碳的质量=148.5g-146.3g,则
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 148.5g-146.3g
=
(2)样品中碳酸钠的质量x=
=5.3g
该固体样品中碳酸钠的质量分数=
×100%=20%
故答案为:
【实验探究】(1)NaOH和Na2CO3的混合物;(2)NaOH;
【实验分析】等于;
【综合计算】(1)
=
;(2)20%.
(2)根据加入稀硫酸的质量与产生CO2气体的质量关系图可知,在一开始加入稀硫酸时并没有气体产生,说明此时所加稀硫酸与氢氧化钠发生反应;
【实验分析】变质前后钠元素质量不变,所以与硫酸充分反应后生成的硫酸钠的质量一定相等,而相等的硫酸钠中硫酸根的质量相同,所以,变质前后所消耗稀硫酸的质量相等;
【综合计算】(1)根据质量质量守恒定律,反应放出二氧化碳的质量=148.5g-146.3g,则
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 148.5g-146.3g
| 106 |
| 44 |
| x |
| 148.5g-146.3g |
(2)样品中碳酸钠的质量x=
| 106×(148.5g-146.3g) |
| 44 |
该固体样品中碳酸钠的质量分数=
| 5.3g |
| 26.5g |
故答案为:
【实验探究】(1)NaOH和Na2CO3的混合物;(2)NaOH;
【实验分析】等于;
【综合计算】(1)
| 106 |
| 44 |
| x |
| 148.5g-146.3g |
点评:在对表示反应过程的曲线进行分析时,要注意对曲线起点、折点这些特殊点所表示的意义进行正确分析与判断.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题.

(1)写出实验室制取氧气的一个化学方程式______,利用该反应制取氧气,发生装置应选______(填序号),组装好实验装置后应进行的操作是______.
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,则收集一氧化氮气体时选用的装置是______(填序号).
(3)按图F做细铁丝在氧气中燃烧的实验,观察到的现象有______.
(4)某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末成分产生浓厚兴趣,并在老师的指导下进行探究活动.
【提出问题】这种单黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体,在呼吸面具中和潜水艇里常用作供氧剂.
【猜想与探究】猜想:淡黄色粉末可能是:A.硫;B.过氧化钠;C.______(请补充完成猜想C)
探究:过氧化钠与水反应的生成物的成分.
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | ______ ______ | 猜想A、C不成立 猜想B成立 |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有______ |
| ②往①试管内的溶液中滴加______ | ______ | 生成物有氢氧化钠 |
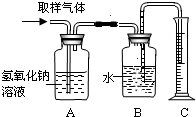 学校化学实验室也是一个污染源,全国数以万计的高效、中学的化学实验室每天都在排放着成分复杂的污染物.为此某学校化学研究小组拟进行如下实验,以粗略测试刚做完实验的实验室(甲)空气中全部酸性气体的含量.步骤如下:
学校化学实验室也是一个污染源,全国数以万计的高效、中学的化学实验室每天都在排放着成分复杂的污染物.为此某学校化学研究小组拟进行如下实验,以粗略测试刚做完实验的实验室(甲)空气中全部酸性气体的含量.步骤如下:
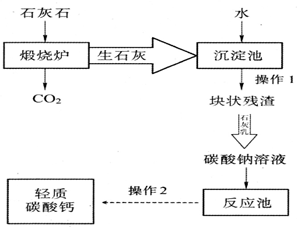 碳酸钙的新用途
碳酸钙的新用途