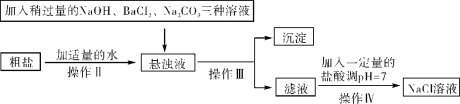
题目内容
【题目】迦逊同学周末和家人去武隆芙蓉洞旅游,带回来一些石灰石样品,进行自己需要的实验。他称取22g石灰石样品,将200g稀盐酸分四次加入样品中(杂质不溶于水,也不与酸发生反应)。如表是他实验数据的记录:
加入稀盐酸/g | 50 | 50 | 50 | 50 |
烧杯内剩余固体的质量/g | 16 | 10 | m | 2 |
请根据迦逊同学的实验数据完成下列问题:
(1)数据m的值为_____;所用稀盐酸的溶质质量分数为_____。
(2)第四次加入稀盐酸后所得溶液中氯化钙的质量分数是多少________?
【答案】4 ;8.76% 。10.5%。
【解析】
(1)由表可知,每50h稀盐酸和6g固体反应,因此m值为4;
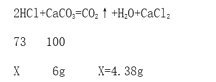
6g 石灰石消耗盐酸质量X=4.38g,稀盐酸总质量为50g,因此盐酸溶液的质量分数为:
4.38÷50×100%=8.76%;
(2)第四次加入稀盐酸后,碳酸钙已经完全反应,反应的碳酸钙的质量为20g.
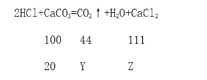
生成氯化钙的质量Z=22.2g,二样化碳的质量Y=8.8g。
根据化学反应前后质量守恒可知,最后溶液的质量为50+50+50+50+22-2-8.8=211.2g,所以氯化钙的质量分数为10.5%。

练习册系列答案
相关题目