题目内容
从事科学实验的重要环节是进行科学实验设计.科学实验的正确步骤应为:①明确实验目的;②收集有关资料;③设计合理方案;④进行科学实验.请你按照以上四个步骤,完成以下实验设计,根据图回答问题: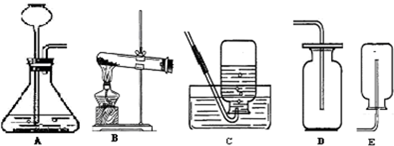
(1)在实验室中用过氧化氢(H2O2)制取氧气.
[明确实验目的]:用过氧化氢在实验室里制取氧气.
[收集有关资料]过氧化氢是一种无色液体,在二氧化锰的催化作用下,迅速分解出氧气,其反应的文字表达式或化学方程式为:
[设计合理方案]:发生装置选用
[进行科学实验]
①分液漏斗中应放入的物质是
②要收集一瓶纯净的氧气应选择图中的装置
③某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集氧气,过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因是
④若实验时用此法代替高锰酸钾加热制氧气,优点是
A.生成物中只有氧气 B.不需加热 C.需加热
⑤装置A中反应剧烈,据此提出实验安全注意事项是
A.改用分液漏斗控制液体的滴加速度 B.用体积小的锥形瓶 C.加热反应物
(2)在实验室中,可以用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气.
①[明确实验目的]:
②[收集有关资料]:氯酸钾是白色的固体,二氧化锰是黑色的固体.且二氧化锰在反应中
③设计合理方案:发生装置选用

(1)在实验室中用过氧化氢(H2O2)制取氧气.
[明确实验目的]:用过氧化氢在实验室里制取氧气.
[收集有关资料]过氧化氢是一种无色液体,在二氧化锰的催化作用下,迅速分解出氧气,其反应的文字表达式或化学方程式为:
2H2O2
2H2O+O2↑(或文字表达式:过氧化氢
水+氧气);
| ||
| MnO2 |
2H2O2
2H2O+O2↑(或文字表达式:过氧化氢
水+氧气);
.
| ||
| MnO2 |
[设计合理方案]:发生装置选用
A
A
(填序号,下同),收集装置选用C或D
C或D
.[进行科学实验]
①分液漏斗中应放入的物质是
过氧化氢溶液
过氧化氢溶液
,锥形瓶中应放入的物质是二氧化锰
二氧化锰
.②要收集一瓶纯净的氧气应选择图中的装置
C
C
(填字母)③某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集氧气,过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因是
装置漏气
装置漏气
.④若实验时用此法代替高锰酸钾加热制氧气,优点是
B
B
(填序号)A.生成物中只有氧气 B.不需加热 C.需加热
⑤装置A中反应剧烈,据此提出实验安全注意事项是
A
A
A.改用分液漏斗控制液体的滴加速度 B.用体积小的锥形瓶 C.加热反应物
(2)在实验室中,可以用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气.
①[明确实验目的]:
用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气
用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气
.②[收集有关资料]:氯酸钾是白色的固体,二氧化锰是黑色的固体.且二氧化锰在反应中
起催化作用
起催化作用
.反应原理(表达式)2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;
| ||
| △ |
③设计合理方案:发生装置选用
B
B
,若选用D收集装置收集氧气,你验证集气瓶中是否已收集满的方法是用带火星的木条伸入集气瓶口,看是否熄灭
用带火星的木条伸入集气瓶口,看是否熄灭
.分析:(1)过氧化氢在二氧化锰的作用下分解成水和氧气,写出其反应方程式;根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集装置;
①固体一般从锥形瓶口加入,液体从长颈漏斗口加入;②排空气法和排水法相对来说,排水法收集的气体更纯;③装置漏气就收集不到气体;④根据操作的简单性及生成的产物分析;⑤根据分液漏斗的作用分析;
(2)①实验目的要根据下面的步骤去推并模仿(1)来写;②根据催化剂的作用回答;③氯酸钾制氧气需要加热,根据氧气能使带火星的木条复燃的特性来验满.
①固体一般从锥形瓶口加入,液体从长颈漏斗口加入;②排空气法和排水法相对来说,排水法收集的气体更纯;③装置漏气就收集不到气体;④根据操作的简单性及生成的产物分析;⑤根据分液漏斗的作用分析;
(2)①实验目的要根据下面的步骤去推并模仿(1)来写;②根据催化剂的作用回答;③氯酸钾制氧气需要加热,根据氧气能使带火星的木条复燃的特性来验满.
解答:解:(1)过氧化氢制氧气的反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,所以反应方程式为:2H2O2
2H2O+O2↑
(或文字表达式:过氧化氢
水+氧气);
用过氧化氢制取氧气是固体与液体,不需要加热,所以发生装置是A,氧气不易溶于水且密度比空气大,所以可以用C或D来收集;
①过氧化氢溶液从长颈漏斗口加入,二氧化锰从锥形瓶口加入;
②排空气法和排水法相对来说,排水法收集的气体更纯;
③根据观察到锥形瓶内有大量气泡产生,说明反应产生了氧气;但开始用C装置收集氧气,过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃,说明气体溢出了,装置漏气;
④根据两种方法的反应条件,可知用过氧化氢溶液分解不需要加热,操作就比较简单;产物都不止一种,故选择B;
⑤装置A中反应剧烈,说明可能是反应物浓度太大或滴加速度太快,而分液漏斗可以控制液体滴加的速度;用体积小的锥形瓶不会改变反应速度;加热会加快反应;故选择:A;
(2)①通过下面的收集资料就能判断实验目的是:用氯酸钾制取氧气;
②催化剂所起的作用叫催化作用;反应的方程式为:2KClO3
2KCl+3O2↑;
③固体与固体制取气体需要加热,所以发生装置选择B,因为氧气能使带火星的木条复燃,所以用带火星的木条来验满,放到瓶口能复燃说明满了,否则不满.
故答案为:(1)2H2O2
2H2O+O2↑(或过氧化氢
水+氧气);A;C或D;①过氧化氢溶液 二氧化锰; ②C; ③装置漏气;④B;⑤A;
(2)①用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气;②起催化作用;2KClO3
2KCl+3O2↑;③B;用带火星的木条放到集气瓶口,看是否熄灭.
| ||
(或文字表达式:过氧化氢
| MnO2 |
用过氧化氢制取氧气是固体与液体,不需要加热,所以发生装置是A,氧气不易溶于水且密度比空气大,所以可以用C或D来收集;
①过氧化氢溶液从长颈漏斗口加入,二氧化锰从锥形瓶口加入;
②排空气法和排水法相对来说,排水法收集的气体更纯;
③根据观察到锥形瓶内有大量气泡产生,说明反应产生了氧气;但开始用C装置收集氧气,过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃,说明气体溢出了,装置漏气;
④根据两种方法的反应条件,可知用过氧化氢溶液分解不需要加热,操作就比较简单;产物都不止一种,故选择B;
⑤装置A中反应剧烈,说明可能是反应物浓度太大或滴加速度太快,而分液漏斗可以控制液体滴加的速度;用体积小的锥形瓶不会改变反应速度;加热会加快反应;故选择:A;
(2)①通过下面的收集资料就能判断实验目的是:用氯酸钾制取氧气;
②催化剂所起的作用叫催化作用;反应的方程式为:2KClO3
| ||
| △ |
③固体与固体制取气体需要加热,所以发生装置选择B,因为氧气能使带火星的木条复燃,所以用带火星的木条来验满,放到瓶口能复燃说明满了,否则不满.
故答案为:(1)2H2O2
| ||
| MnO2 |
(2)①用加热氯酸钾(KClO3)和二氧化锰固体混合物制取氧气;②起催化作用;2KClO3
| ||
| △ |
点评:通过本题学生进一步明确了科学实验的正确步骤,通过分析本题加深了气体收集方法的选取方法,发生装置的选择方法,氧气的验满方法等.

练习册系列答案
相关题目