题目内容
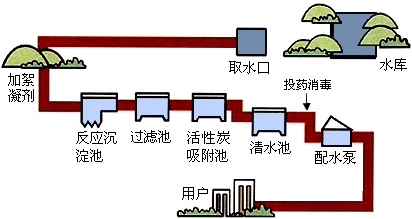
自然界中的水含有许多可溶性和不溶性杂质,通过多种途径可以使水得到不同程度的净化.下图是自来水厂净化水过程示意图.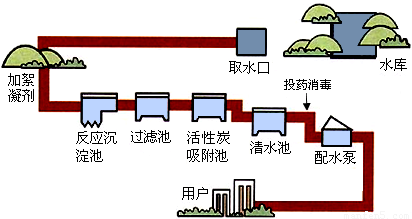
(1)上述净化水的方法有:沉淀、 、 、消毒等.
(2)投药消毒的目的是杀灭水中的细菌、病毒和寄生虫.自来水厂常用二氧化氯(ClO2)作消毒剂,其中氯元素的化合价为 ;完成下列工业制二氧化氯的化学反应方程式:Cl2+2NaClO2═2ClO2+ .
(3)我们应当珍惜每一滴水,下列做法不利于节约用水的是 .
A.洗菜的水用来浇花 B.未喝完的矿泉水随手倒掉
C.用不间断的流水冲洗碗筷 D.洗澡擦浴液时,关上水龙头
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一.请写出固体Ca(HCO3)2受热分解的化学方程式 .
【答案】分析:(1)观察净水过程分析净水方法;
(2)根据化合物中化合价总和是0,化学反应前后元素的种类和原子个数不变解答;
(3)根据节约用水的原则进行分析;
(4)根据反应物、生成物书写方程式.
解答:解:(1)观察净水过程示意图可知:净水方法还有过滤、吸附;
故答案为:过滤;吸附;
(2)化合物中化合价总和是0,二氧化氯中,氧元素是-2价,所以氯元素的化合价是+4价,化学反应前有氯元素、钠元素和氧元素,且反应前有4个氯原子,2个钠原子,4个氧原子,所以该空应为2NaCl;
故答案为:+4;2NaCl;
(3)生活中可使用节水龙头,洗菜水浇花等进行节约水,显然BC不符合节水原则;故选BC;
(4)碳酸氢钙受热分解生成难溶性的碳酸钙、水和二氧化碳,反应的方程式是Ca(HCO3)2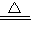 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
故答案为:Ca(HCO3)2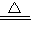 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
点评:本题主要考查了常用净水方法,元素的化合价及方程式的书写、判断物质的化学式等知识,掌握相关内容即可顺利解答.
(2)根据化合物中化合价总和是0,化学反应前后元素的种类和原子个数不变解答;
(3)根据节约用水的原则进行分析;
(4)根据反应物、生成物书写方程式.
解答:解:(1)观察净水过程示意图可知:净水方法还有过滤、吸附;
故答案为:过滤;吸附;
(2)化合物中化合价总和是0,二氧化氯中,氧元素是-2价,所以氯元素的化合价是+4价,化学反应前有氯元素、钠元素和氧元素,且反应前有4个氯原子,2个钠原子,4个氧原子,所以该空应为2NaCl;
故答案为:+4;2NaCl;
(3)生活中可使用节水龙头,洗菜水浇花等进行节约水,显然BC不符合节水原则;故选BC;
(4)碳酸氢钙受热分解生成难溶性的碳酸钙、水和二氧化碳,反应的方程式是Ca(HCO3)2
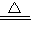 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑故答案为:Ca(HCO3)2
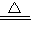 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑点评:本题主要考查了常用净水方法,元素的化合价及方程式的书写、判断物质的化学式等知识,掌握相关内容即可顺利解答.

练习册系列答案
相关题目