题目内容
【题目】为测定大理石样品中碳酸钙的质量分数,取 6g 样品置于烧杯中,向其中加入 5%的稀盐酸,恰好不再有气泡产生时(已知杂质不与稀盐酸反应)。共用去稀盐酸 73g。
①该实验中能否用稀硫酸代替稀盐酸______(填“能”或“不能”)。
②用质量分数为 36%的浓盐酸100g 能配制所需5%的稀盐酸______g。
③计算样品中碳酸钙的质量分数______。(根据化学方程式计算,精确到 0.1%)
【答案】不能 720 83.3%
【解析】
(1)碳酸钙可以和稀硫酸反应生成硫酸钙、水和二氧化碳,但生成的硫酸钙微溶于水,覆盖在大理石表面阻止反应的进一步进行,不能使碳酸钙完全反应,所以不能用稀硫酸来代替稀盐酸;
(2)设:能配制5%的稀盐酸的质量为x,则根据稀释前后溶质的质量不变可得:
100g×36%=x×5% 解得:x=720g;
(3)设6g样品中CaCO3的质量为y。
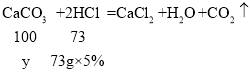
![]() 解得:y=5g;
解得:y=5g;
样品中碳酸钙的质量分数=![]() 。
。
答:样品中碳酸钙的质量分数为83.3%.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
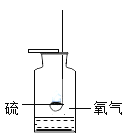
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D |
硫在氧气中燃烧
| 测定空气中氧气含量
| 铁丝在氧气中燃烧
| 排水法收集呼出的气体
|
集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察呼出气体何时收集满 |
A.AB.BC.CD.D
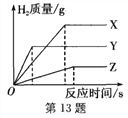
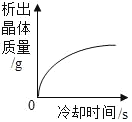
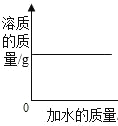
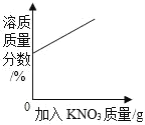
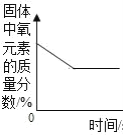
【题目】下列各图象不能正确反映其对应操作中各量变化关系的是( )
|
|
|
|
A某温度下热的硝酸钾饱和溶液逐渐冷却至室温 | B向一定量的氯化钠溶液中加水稀释 | C向一定量的硝酸钾不饱和溶液中加入硝酸钾 | D加热高锰酸钾固体 |
A.AB.BC.CD.D