题目内容
(6分)下图是有关稀盐酸和氢氧化钠溶液发生化学反应的微观示意图。请回答下列问题:
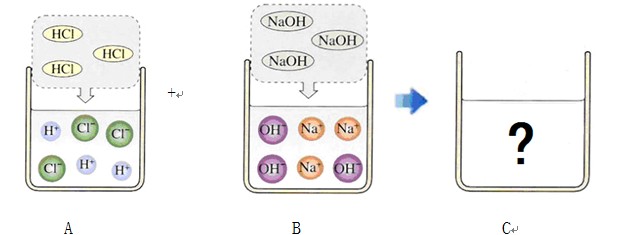
(1)A中溶液能使紫色石蕊溶液显 色,因为其中含有较多的(填粒子符号)_______;B中溶液能使无色酚酞溶液显 色,因为其中含有较多的(填粒子符号)________。
(2)将50 g 7.3% 的A中的溶液与50 g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号)________;C中的溶液中溶质的质量分数是______ 。

(1)A中溶液能使紫色石蕊溶液显 色,因为其中含有较多的(填粒子符号)_______;B中溶液能使无色酚酞溶液显 色,因为其中含有较多的(填粒子符号)________。
(2)将50 g 7.3% 的A中的溶液与50 g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号)________;C中的溶液中溶质的质量分数是______ 。
(1)红,H+ 红,OH-
(2)Na+、Cl-、H2O, 5.85%
(2)Na+、Cl-、H2O, 5.85%
试题分析:(1)酸的溶液能使石蕊变红,是因为含有氢离子的缘故;碱的溶液能使酚酞变红,是因为氢氧根离子的缘故。
(2)氢氧化钠与盐酸反应时的方程式是:NaOH+HCl=NaCl+H2O,两者反应时的质量比是40:36.5,50g 7.3% 的盐酸与50g 8% 的氢氧化钠溶液,所含溶质的质量比正好与之相等,也就是说两者恰好反应,则溶质是氯化钠,溶剂是水,所以溶液中的粒子主要是氯离子、钠离子与水分子。
设生成氯化钠的质量是x
NaOH+HCl=NaCl+H2O
40 58.5
50g×8% x
40:58.5=50g×8%:x
解得,x=5.85g
则C中的溶液中溶质的质量分数是=
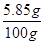 ×100%=5.85%
×100%=5.85%点评:解答本题时,要学会通过宏观的现象找到微观的原因;关于第二问含杂质的化学方程式的计算,要注意代入方程式计算的质量,应该是参加反应的纯净物的质量,不可忽略。

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目