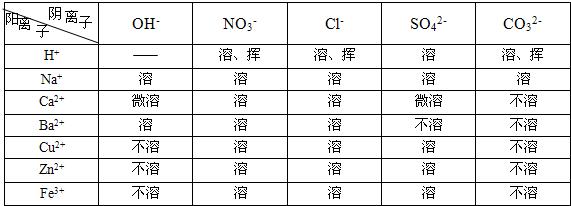
题目内容
现有一包白色的固体,里面可能含有氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种.为了鉴别成分,确定是否含有某种物质,做下列实验:
实验一:取白色固体加水溶解,形成无色溶液;
实验二:取上述溶液滴加稀硝酸,有气体放出,继续加入稀硝酸至不再放出气体为止;
实验三:取上述溶液滴加稀硝酸钡溶液,有白色沉淀,继续加入硝酸钡至不再产生沉淀为止;
实验四:将上述混合物过滤,再向无色滤液中加入适量硝酸银溶液,产生了白色沉淀.
根据上述实验回答:
(1)实验一证明了固体中不含
(2)实验二证明并且除去了
(3)实验三发生反应的化学方程式为
(4)为了确定各种物质是否都含有,实验三和实验四的先后顺序能否交换?
实验一:取白色固体加水溶解,形成无色溶液;
实验二:取上述溶液滴加稀硝酸,有气体放出,继续加入稀硝酸至不再放出气体为止;
实验三:取上述溶液滴加稀硝酸钡溶液,有白色沉淀,继续加入硝酸钡至不再产生沉淀为止;
实验四:将上述混合物过滤,再向无色滤液中加入适量硝酸银溶液,产生了白色沉淀.
根据上述实验回答:
(1)实验一证明了固体中不含
硫酸铜
硫酸铜
(2)实验二证明并且除去了
碳酸钠
碳酸钠
(3)实验三发生反应的化学方程式为
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
(4)为了确定各种物质是否都含有,实验三和实验四的先后顺序能否交换?
不能
不能
(填写“能”或“不能”)分析:依据实验中出现的较为典型的实验现象分析解答,主要是利用铜盐的溶液呈蓝色,碳酸盐与酸反应能够生成气体,硫酸钡、氯化银是白色沉淀,据此分析解答即可;
解答:解:(1)由于硫酸铜的溶液呈蓝色,而实验一中取白色固体加水溶解,形成无色溶液,所以原固体中一定无硫酸铜;
(2)碳酸盐遇酸会生成二氧化碳,故取上述溶液滴加稀硝酸,有气体放出,说明原固体中存在碳酸钠;继续加入硝酸钡至不再产生沉淀为止;说明碳酸钠已经完全反应;
(3)取上述溶液滴加稀硝酸钡溶液,有白色沉淀,说明溶液中含有硫酸钠,硫酸钠与硝酸钡反应能够生成硫酸钡的白色沉淀,方程式为:Na2SO4+Ba(NO 3)2=BaSO4↓+2NaNO3;
(4)由于实验四是证明氯化钠的存在的实验,由于硫酸银是微溶物,所以含有硫酸钠的溶液加入硝酸银后也可能会有白色沉淀生成,故该实验不能与实验四颠倒;
故答案为:(1)硫酸铜;(2)碳酸钠;(3)Na2SO4+Ba(NO 3)2=BaSO4↓+2NaNO3;(4)不能;
(2)碳酸盐遇酸会生成二氧化碳,故取上述溶液滴加稀硝酸,有气体放出,说明原固体中存在碳酸钠;继续加入硝酸钡至不再产生沉淀为止;说明碳酸钠已经完全反应;
(3)取上述溶液滴加稀硝酸钡溶液,有白色沉淀,说明溶液中含有硫酸钠,硫酸钠与硝酸钡反应能够生成硫酸钡的白色沉淀,方程式为:Na2SO4+Ba(NO 3)2=BaSO4↓+2NaNO3;
(4)由于实验四是证明氯化钠的存在的实验,由于硫酸银是微溶物,所以含有硫酸钠的溶液加入硝酸银后也可能会有白色沉淀生成,故该实验不能与实验四颠倒;
故答案为:(1)硫酸铜;(2)碳酸钠;(3)Na2SO4+Ba(NO 3)2=BaSO4↓+2NaNO3;(4)不能;
点评:本题是混合物组成推断题,要善于抓住“题眼”,如本题中的无色溶液,加硝酸生成气体等都是解题的突破口.

练习册系列答案
相关题目