题目内容
(2013?镇江模拟)一包白色固体粉末可能由NH4Cl、Na2CO3、BaCl2、CuSO4、NaCl、Na2SO4中的一种或几种组成.为确定其组成,做了如下实验:
①取少量粉末于研钵中,加入熟石灰粉末混合、研磨,没有闻到氨味;
②另取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液;过滤,向沉淀中加入稀硝酸,沉淀全部溶解,有气泡.
试回答:
(1)白色固体中肯定含有
(2)写出实验②中出现白色沉淀的化学反应方程式
①取少量粉末于研钵中,加入熟石灰粉末混合、研磨,没有闻到氨味;
②另取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液;过滤,向沉淀中加入稀硝酸,沉淀全部溶解,有气泡.
试回答:
(1)白色固体中肯定含有
氯化钡
氯化钡
、碳酸钠
碳酸钠
,肯定不含有氯化铵
氯化铵
、硫酸铜
硫酸铜
、硫酸钠
硫酸钠
;(2)写出实验②中出现白色沉淀的化学反应方程式
Na2CO3+BaCl2═BaCO3↓+2NaCl
Na2CO3+BaCl2═BaCO3↓+2NaCl
.分析:根据题目给出的信息:取少量白色粉末于研钵中,加入少量的熟石灰粉末混合,研磨,没有闻到氨味,说明一定没有氯化铵;另取少量白色粉末加入到适量的水中,出现白色浑浊,静置后,上层清液无色,因此一定没有硫酸铜;白色沉淀可能是碳酸钡,小心倒掉上层清液,向沉淀中加入稀硝酸,白色沉淀完全溶解,并有无色无味的气体产生,那么一定是碳酸钡,因此混合物中一定有Na2CO3和BaCl2,一定不含硫酸钠,NaCl可能有,也可能没有.
解答:解:①取少量粉末于研钵中,加入熟石灰粉末混合、研磨,没有闻到氨味;说明一定没有氯化铵;
②另取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液,说明一定不含硫酸铜,过滤,向沉淀中加入稀硝酸,沉淀全部溶解,有气泡.说明该沉淀是碳酸钡,不是硫酸钡,因此原固体中一定含有氯化钡、碳酸钠,一定不含硫酸钠;
(1)白色固体中肯定含有氯化钡、碳酸钠,一定不含氯化铵、硫酸铜和硫酸钠;
(2)实验②中出现白色沉淀的反应是碳酸钠和氯化钡生成碳酸钡沉淀的过程,方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl;
故答案为:(1)氯化钡;碳酸钠;氯化铵;硫酸铜;硫酸钠;(2)Na2CO3+BaCl2═BaCO3↓+2NaCl;
②另取少量粉末加入足量的水,搅拌、静置,得白色沉淀和无色清液,说明一定不含硫酸铜,过滤,向沉淀中加入稀硝酸,沉淀全部溶解,有气泡.说明该沉淀是碳酸钡,不是硫酸钡,因此原固体中一定含有氯化钡、碳酸钠,一定不含硫酸钠;
(1)白色固体中肯定含有氯化钡、碳酸钠,一定不含氯化铵、硫酸铜和硫酸钠;
(2)实验②中出现白色沉淀的反应是碳酸钠和氯化钡生成碳酸钡沉淀的过程,方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl;
故答案为:(1)氯化钡;碳酸钠;氯化铵;硫酸铜;硫酸钠;(2)Na2CO3+BaCl2═BaCO3↓+2NaCl;
点评:解此类题,主要从离子的带色问题和离子的共存问题方面进行分析,熟练掌握常见的盐的性质,知道铜盐的溶液为蓝色,而不溶于硝酸的白色沉淀只有硫酸钡和氯化银两种物质是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?镇江模拟)仔细观察右边的漫画后回答:
(2013?镇江模拟)仔细观察右边的漫画后回答: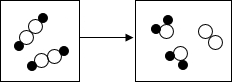 (2013?镇江模拟)用“○”和“●”分别代表两种不同元素的原子,这两种元素组成的物质在一定条件下能发生反应,反应前后的微观模拟图如下.下列说法正确的是( )
(2013?镇江模拟)用“○”和“●”分别代表两种不同元素的原子,这两种元素组成的物质在一定条件下能发生反应,反应前后的微观模拟图如下.下列说法正确的是( )