题目内容
10℃时分别将10g甲、乙两种固体物质放入100g水中,充分搅拌后如图A所示.再将两溶液升温至30℃,充分搅拌后如图B所示.图C是两种物质的溶解度曲线.回答下列问题:
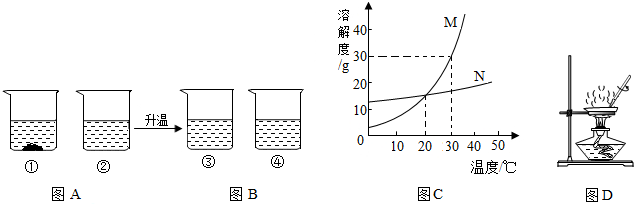
(1)图C中表示甲物质的溶解度曲线的是 (填字母).
(2)图A的烧杯中一定是饱和溶液的是 (填序号).
(3)要使烧杯③中的溶液变为饱和溶液,在温度不变的情况下至少需加入 g甲.
(4)小明取等量的③④中的溶液同时蒸发,较快析出晶体的是哪一种,并说明原因
(5)蒸发装置如图D所示,当操作进行到 时停止加热.

(1)图C中表示甲物质的溶解度曲线的是
(2)图A的烧杯中一定是饱和溶液的是
(3)要使烧杯③中的溶液变为饱和溶液,在温度不变的情况下至少需加入
(4)小明取等量的③④中的溶液同时蒸发,较快析出晶体的是哪一种,并说明原因
(5)蒸发装置如图D所示,当操作进行到
考点:固体溶解度曲线及其作用,蒸发与蒸馏操作,饱和溶液和不饱和溶液,晶体和结晶的概念与现象
专题:溶液、浊液与溶解度
分析:(1)观察图AB可知10℃时甲的溶解度小于乙的溶解度,依此分析判断;
(2)溶液中溶质有剩余的一定是该物质的饱和溶液;
(3)依据不同温度下物质的溶解度分析计算作答;
(4)观察图C,依据物质溶解度受温度影响情况分析作答;
(5)依据蒸发操作要点和注意事项作答;
(2)溶液中溶质有剩余的一定是该物质的饱和溶液;
(3)依据不同温度下物质的溶解度分析计算作答;
(4)观察图C,依据物质溶解度受温度影响情况分析作答;
(5)依据蒸发操作要点和注意事项作答;
解答:解:
(1)观察图AB可知10℃时甲的溶解度小于乙的溶解度,观察图C,表示甲物质的溶解度曲线的是M;
(2)溶液中溶质有剩余的一定是该物质的饱和溶液,故选:①;
(3)30℃时甲物质的溶解度是30g,要使烧杯③中的溶液变为饱和溶液,在温度不变的情况下至少需加入(30-10)g=20g;
(4)观察图C,因为④中乙物质溶解度受温度影响较小,③中甲物质溶解度受温度影响较大,而蒸发时温度较高,甲物质溶解度较大,不易析出;所以较快析出晶体的是④;
(5)依据蒸发操作要点和注意事项知:蒸发装置如图D所示,当操作进行到有大量晶体析出时停止加热.
故答案为:
(1)M;
(2)①;
(3)20;
(4)较快析出晶体的是④,因为④中乙物质溶解度受温度影响较小,③中甲物质溶解度受温度影响较大,而蒸发时温度较高,甲物质溶解度较大,不易析出;
(5)有大量晶体析出.
(1)观察图AB可知10℃时甲的溶解度小于乙的溶解度,观察图C,表示甲物质的溶解度曲线的是M;
(2)溶液中溶质有剩余的一定是该物质的饱和溶液,故选:①;
(3)30℃时甲物质的溶解度是30g,要使烧杯③中的溶液变为饱和溶液,在温度不变的情况下至少需加入(30-10)g=20g;
(4)观察图C,因为④中乙物质溶解度受温度影响较小,③中甲物质溶解度受温度影响较大,而蒸发时温度较高,甲物质溶解度较大,不易析出;所以较快析出晶体的是④;
(5)依据蒸发操作要点和注意事项知:蒸发装置如图D所示,当操作进行到有大量晶体析出时停止加热.
故答案为:
(1)M;
(2)①;
(3)20;
(4)较快析出晶体的是④,因为④中乙物质溶解度受温度影响较小,③中甲物质溶解度受温度影响较大,而蒸发时温度较高,甲物质溶解度较大,不易析出;
(5)有大量晶体析出.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
某同学在实验时进行如下操作,其中不正确的是( )
| A、甩过的药匙或镊子立即用干净的纸擦拭干净 |
| B、在无用量说明时,液体取用1~2毫升,固体只是盖满试管的底部 |
| C、用手指沾取实验室中所用的食盐,品尝其味道 |
| D、为了节约药品将实验剩余的药品放回原瓶 |
