题目内容
下图是甲、乙两种物质的溶解度曲线,请结合图示回答问题:
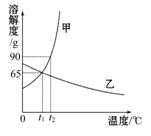
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是  。
。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 (填“大于”“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
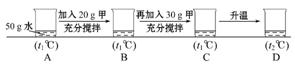
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
本题考查学生对溶解度曲线的判断和掌握能力。解答本题的关键应明确两点:(1)溶解度曲线的意义;(2)溶质质量分数与溶解度的关系。t1℃时,乙的溶解度等于甲的溶解度;甲的溶解度随温度升高而升高,乙的溶解度随温度升高而降低;由于甲的溶解度受温度的影响较大,故应采用降温结晶的方法使其从饱和溶液中结晶析出;饱和溶液的质量分数=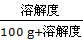 ×100%,所以饱和溶液的质量分数与溶解度有关,因为t2℃时甲、乙的饱和溶液同时降温至t1℃后,甲析出晶体仍然饱和,乙变为不饱和溶液,溶质质量分数不变,所以只要比较出t1℃甲的溶解度与t2℃时乙的溶解度大小即可,由溶解度曲线图可知t1℃甲的溶解度大于
×100%,所以饱和溶液的质量分数与溶解度有关,因为t2℃时甲、乙的饱和溶液同时降温至t1℃后,甲析出晶体仍然饱和,乙变为不饱和溶液,溶质质量分数不变,所以只要比较出t1℃甲的溶解度与t2℃时乙的溶解度大小即可,由溶解度曲线图可知t1℃甲的溶解度大于 t2℃时乙的溶解度,所以降温后甲的溶质质量分数大于乙的溶质质量分数;根据溶解度的概念,t1℃时,甲的溶解度为65 g,故50 g水中最多溶解甲的质量为65 g÷2=32.5 g,因此加入20 g的甲时,所得溶液不饱和,再加入30 g时不能完全溶解,此时溶液达到饱和,升温至t2℃时,该温度下,甲的溶解度为90 g,故50 g水中最多溶解甲的质量为90 g÷2=45 g<(20+30)g,故溶液仍饱和;向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,说明其溶解度变大,应为溶液的温度升高导致。
t2℃时乙的溶解度,所以降温后甲的溶质质量分数大于乙的溶质质量分数;根据溶解度的概念,t1℃时,甲的溶解度为65 g,故50 g水中最多溶解甲的质量为65 g÷2=32.5 g,因此加入20 g的甲时,所得溶液不饱和,再加入30 g时不能完全溶解,此时溶液达到饱和,升温至t2℃时,该温度下,甲的溶解度为90 g,故50 g水中最多溶解甲的质量为90 g÷2=45 g<(20+30)g,故溶液仍饱和;向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,说明其溶解度变大,应为溶液的温度升高导致。
答案:(1)t1 (2)乙
(3)降温结晶(合理均可)
(4)大于
(5)①B ②甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案



