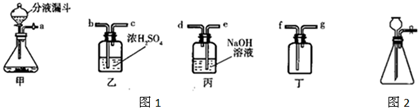
题目内容
向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量.(为便于计算设溶液的密度为1g/cm3)(1)请将产生不同沉淀阶段的沉淀的化学式与加入Ba(OH)2溶液体积(V)间的关系填入下表:
| Ba(OH)2溶液体积(V)/mL | ||||
| 沉淀的化学式 |
【答案】分析:向盐酸和MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应;若OH-先和Mg2+产生沉淀Mg(OH)2,由于HCl的存在,HCl能将生成Mg(OH)2溶解,故OH-先跟盐酸的H+反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀.
解答:解:(1)100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,氯化氢的质量=100g×3.65%=3.65g,硫酸镁的质量=100g×12%=12g;向盐酸和MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀;
设与3.65g氯化氢完全反应,需要质量分数为3.42%的Ba(OH)2的体积为V,
2HCl+Ba(OH)2═BaCl2+H2O
73 171
3.65g V×1g/mL×3.42%
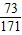 =
=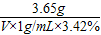
解得:v=250mL
因为:BaCl2+MgSO4═BaSO4↓+MgCl2,由以上两个方程式得出关系式:2HCl~BaSO4~MgSO4~MgCl2
设生成硫酸钡的质量为x,反应掉的硫酸镁的质量为y,生成的氯化镁质量为z
所以:2HCl~BaSO4~MgSO4~MgCl2
73 233 120 95
3.65g x y z
 =
=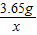
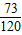 =
=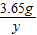
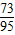 =
=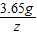
解得:x=11.65g y=6g z=4.75g
这时的溶液是硫酸镁和氯化镁的混合溶液,当加入氢氧化钡溶液时产生了硫酸钡沉淀和氢氧化镁沉淀;当硫酸镁完全反应后,再加入氢氧化钡溶液时只产生氢氧化镁沉淀,当氯化镁完全反应后再加入氢氧化钡溶液时 不再产生沉淀.溶液中硫酸镁的质量为12g-6g=6g;
设6g的硫酸镁与氢氧化钡反应生成的生成的硫酸钡为p,氢氧化镁为q,氢氧化钡溶液的体积为m
MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓
120 171 233 58
6g m×1g/mL×3.42% p q
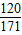 =
=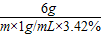
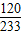 =
=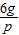
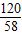 =
=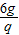
解得:m=250mL p=11.65g q=2.9g
再设4.75g的氯化镁与氢氧化钡溶液反应,需氢氧化钡溶液的体积为n,生成的氢氧化镁沉淀的质量为r
MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓
95 171 58
4.75g n×1g/mL×3.42% r
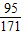 =
=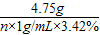
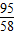 =
=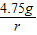
解得:n=250mL r=2.9g
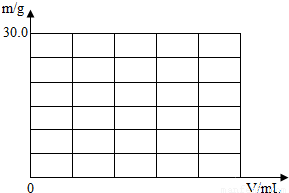
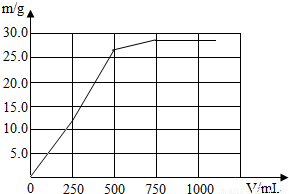
所以:(1)加入0~250mL质量分数为3.42%的Ba(OH)2溶液时,只产生硫酸钡沉淀,沉淀质量为0~11.65g;当加入250~500mL的Ba(OH)2溶液时产生的是硫酸钡和氢氧化镁沉淀,沉淀质量为11.65g~26.2g;当加入500~750mL的Ba(OH)2溶液时,只产生氢氧化镁沉淀,沉淀质量为26.2g~29.1g;当加入Ba(OH)2溶液大于750mL时,不产生沉淀,得出下表:
(2)根据上述数据可作出沉淀的质量和Ba(OH)2溶液体积(V)间的关系图线:
点评:解答本题的关键是分清:当溶液中含有盐酸时,加入氢氧化钡溶液,不产生氢氧化镁沉淀,只产生硫酸钡沉淀;当溶液中的盐酸完全反应了,这时加入氢氧化钡溶液产生的沉淀是氢氧化镁和硫酸钡的混合物.
解答:解:(1)100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,氯化氢的质量=100g×3.65%=3.65g,硫酸镁的质量=100g×12%=12g;向盐酸和MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀;
设与3.65g氯化氢完全反应,需要质量分数为3.42%的Ba(OH)2的体积为V,
2HCl+Ba(OH)2═BaCl2+H2O
73 171
3.65g V×1g/mL×3.42%
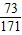 =
=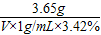
解得:v=250mL
因为:BaCl2+MgSO4═BaSO4↓+MgCl2,由以上两个方程式得出关系式:2HCl~BaSO4~MgSO4~MgCl2
设生成硫酸钡的质量为x,反应掉的硫酸镁的质量为y,生成的氯化镁质量为z
所以:2HCl~BaSO4~MgSO4~MgCl2
73 233 120 95
3.65g x y z
 =
=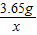
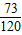 =
=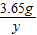
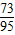 =
=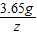
解得:x=11.65g y=6g z=4.75g
这时的溶液是硫酸镁和氯化镁的混合溶液,当加入氢氧化钡溶液时产生了硫酸钡沉淀和氢氧化镁沉淀;当硫酸镁完全反应后,再加入氢氧化钡溶液时只产生氢氧化镁沉淀,当氯化镁完全反应后再加入氢氧化钡溶液时 不再产生沉淀.溶液中硫酸镁的质量为12g-6g=6g;
设6g的硫酸镁与氢氧化钡反应生成的生成的硫酸钡为p,氢氧化镁为q,氢氧化钡溶液的体积为m
MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓
120 171 233 58
6g m×1g/mL×3.42% p q
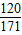 =
=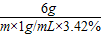
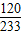 =
=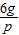
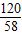 =
=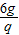
解得:m=250mL p=11.65g q=2.9g
再设4.75g的氯化镁与氢氧化钡溶液反应,需氢氧化钡溶液的体积为n,生成的氢氧化镁沉淀的质量为r
MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓
95 171 58
4.75g n×1g/mL×3.42% r
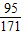 =
=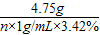
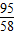 =
=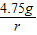
解得:n=250mL r=2.9g
所以:(1)加入0~250mL质量分数为3.42%的Ba(OH)2溶液时,只产生硫酸钡沉淀,沉淀质量为0~11.65g;当加入250~500mL的Ba(OH)2溶液时产生的是硫酸钡和氢氧化镁沉淀,沉淀质量为11.65g~26.2g;当加入500~750mL的Ba(OH)2溶液时,只产生氢氧化镁沉淀,沉淀质量为26.2g~29.1g;当加入Ba(OH)2溶液大于750mL时,不产生沉淀,得出下表:
| Ba(OH)2溶液体积(V)/mL | (0~250] | (250~500] | (500~750] | (750- |
| 沉淀的化学式 | BaSO4 | BaSO4、Mg(OH)2 | Mg(OH)2 | - |

点评:解答本题的关键是分清:当溶液中含有盐酸时,加入氢氧化钡溶液,不产生氢氧化镁沉淀,只产生硫酸钡沉淀;当溶液中的盐酸完全反应了,这时加入氢氧化钡溶液产生的沉淀是氢氧化镁和硫酸钡的混合物.

练习册系列答案
相关题目
32.(10分)向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量。(为便于计算设溶液的密度为1g/cm3)
(1)请将产生不同沉淀阶段的沉淀的化学式与加入Ba(OH)2溶液体积(V)间的关系填入下表:
| Ba(OH)2溶液体积(V)/mL | ||||
| 沉淀的化学式 |
(2)请在下面坐标系中完成沉淀的质量和Ba(OH)2溶液体积(V)间的关系图线。
 |