题目内容
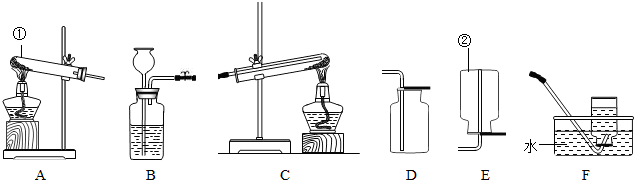
资料显示:“氨气可在纯氧中安静燃烧…”.某校化学兴趣小组学生设计如下装置(图中铁夹等夹持仪器已略去 )进行氨气与氧气在不同条件下反应的实验.

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉 )中,用酒精喷灯加热:氨催化氧化的化学方程式是
(3 )将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气.则:
①两种气体通入C装置时,
②氨气燃烧的化学方程式是

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(NH4)2CO3(或NH4HCO3)
(NH4)2CO3(或NH4HCO3)
;碱石灰的作用是吸收水和二氧化碳
吸收水和二氧化碳
.(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉 )中,用酒精喷灯加热:氨催化氧化的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;试管内气体变为红棕色,该反应的化学方程式是
| ||
| △ |
2NO+O2═2NO2
2NO+O2═2NO2
;(3 )将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气.则:
①两种气体通入C装置时,
O2(或氧气)
O2(或氧气)
应该先通入;②氨气燃烧的化学方程式是
4NH3+3O2
2N2+6H2O
| ||
4NH3+3O2
2N2+6H2O
.
| ||
分析:(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,碱石灰可以吸收酸性气体,并用于干燥氨气;
(2)NH3与过量O2在催化剂铂石棉、加热条件下发生反应:4NH3+5O2
4NO+6H2O,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体;
(3)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
(2)NH3与过量O2在催化剂铂石棉、加热条件下发生反应:4NH3+5O2
| ||
| △ |
(3)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
解答:解:(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3;
(2)NH3与过量O2在催化剂铂石棉、加热条件下发生反应:4NH3+5O2
4NO+6H2O,通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2;
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2
2N2+6H2O(O2置换N2);
故答案为:(1)(NH4)2CO3(或NH4HCO3); 吸收水和二氧化碳;
(2 )4NH3+5O2
4NO+6H2O; 2NO+O2═2NO2;
(3 )①O2(或氧气);
②4NH3+3O2
2N2+6H2O.
(2)NH3与过量O2在催化剂铂石棉、加热条件下发生反应:4NH3+5O2
| ||
| △ |
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2
| ||
故答案为:(1)(NH4)2CO3(或NH4HCO3); 吸收水和二氧化碳;
(2 )4NH3+5O2
| ||
| △ |
(3 )①O2(或氧气);
②4NH3+3O2
| ||
点评:本题为信息给予题,考查氨气的有关性质,做题时注意题中“氨气可在纯氧中安静燃烧…”这一重要信息,并结合氨气的性质解答问题,考查了学生分析、提取信息,解决问题的能力.

练习册系列答案
相关题目