题目内容
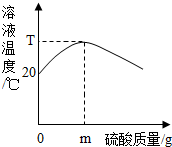
20℃时,在与外界不发生热量交换的密闭容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )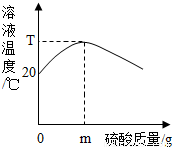
A.硫酸质量大于m克时,密闭容器内含有的溶质是硫酸和硫酸钠
B.硫酸质量等于m克时,密闭容器内含有的溶质是硫酸和硫酸钠
C.若用浓硫酸代替稀硫酸,则恰好反应时溶液温度高于T℃
D.若用40g氢氧化钠固体代替氢氧化钠溶液,则恰好反应时溶液温度高于T℃
【答案】分析:根据溶液温度达到最高点时,说明氢氧化钠溶液和稀硫酸恰好中和,此时消耗硫酸的质量是m,溶液中的溶质只有生成的硫酸钠;若硫酸的质量大于m克时,说明硫酸过量,此时溶液含有的溶质是生成的硫酸钠和过量的硫酸;氢氧化钠固体和浓硫酸溶于水均放热分析.
解答:解;A、溶溶液温度达到最高点时,说明氢氧化钠溶液和稀硫酸恰好中和,此时消耗硫酸的质量是m,若硫酸质量大于m克时,说明硫酸过量,此时溶液含有的溶质是生成的硫酸钠和过量的硫酸,故A说法正确;
B、溶液温度达到最高点时,说明氢氧化钠溶液和稀硫酸恰好中和,此时消耗硫酸的质量是m,溶液中的溶质只有生成的硫酸钠,故B说法错误;
C、因为浓硫酸溶于水放热,若用浓硫酸代替稀硫酸,则恰好反应时溶液温度应高于T℃,故C说法正确;
D、因为氢氧化钠固体溶于水放热,若用氢氧化钠固体代替氢氧化钠溶液,则恰好反应时溶液温度应高于T℃,故C说法正确;
故选项为:B.
点评:本题主要考查了结合图象对中和反应的更深层次的理解,能够读懂坐标的起点、拐点的意义结合化学方程式及浓硫酸、氢氧化钠固体溶解放热进行分析,难度不大.
解答:解;A、溶溶液温度达到最高点时,说明氢氧化钠溶液和稀硫酸恰好中和,此时消耗硫酸的质量是m,若硫酸质量大于m克时,说明硫酸过量,此时溶液含有的溶质是生成的硫酸钠和过量的硫酸,故A说法正确;
B、溶液温度达到最高点时,说明氢氧化钠溶液和稀硫酸恰好中和,此时消耗硫酸的质量是m,溶液中的溶质只有生成的硫酸钠,故B说法错误;
C、因为浓硫酸溶于水放热,若用浓硫酸代替稀硫酸,则恰好反应时溶液温度应高于T℃,故C说法正确;
D、因为氢氧化钠固体溶于水放热,若用氢氧化钠固体代替氢氧化钠溶液,则恰好反应时溶液温度应高于T℃,故C说法正确;
故选项为:B.
点评:本题主要考查了结合图象对中和反应的更深层次的理解,能够读懂坐标的起点、拐点的意义结合化学方程式及浓硫酸、氢氧化钠固体溶解放热进行分析,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 (2013?下城区二模)20℃时,在与外界不发生热量交换的密闭容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )
(2013?下城区二模)20℃时,在与外界不发生热量交换的密闭容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( ) (2012?东城区一模)20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( )
(2012?东城区一模)20℃时,在密闭(与外界不发生热交换)容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是( ) 20℃时,在与外界不发生热量交换的密闭容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是
20℃时,在与外界不发生热量交换的密闭容器中,将400g 10%的氢氧化钠溶液和稀硫酸混合,反应过程中溶液温度与硫酸质量关系如图所示.下列说法不正确的是