题目内容
【题目】回答下列与溶解度有关的问题。
(1)Ca(OH)2的溶解度随温度升高而减小,当加热饱和的石灰水时会出现浑浊现象,该浑浊物是________。
(2)除去CO中混入的CO2,常用NaOH溶液而不用Ca(OH)2溶液,这是因为常温下Ca(OH)2的溶解度比NaOH的溶解度______________。
(3)将一定浓度的CaCl2溶液滴加到NaOH溶液中有白色沉淀产生,有关化学方程式为________________。
(4)控制实验条件通过对比实验现象可以判断酸与碱能发生反应,如图,该实验中的碱可以是下列中的____________。
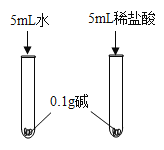
ANaOH BMg(OH)2 CCa(OH)2
【答案】氢氧化钙 小 CaCl2+2NaOH=Ca(OH)2↓+2NaCl BC
【解析】
(1)氢氧化钙的溶解度随着温度的升高而减小,加热后温度升高,溶解度减小,有氢氧化钙析出,溶液由澄清变浑浊,故填:氢氧化钙;
(2)Ca(OH)2是一种微溶物质,溶液中溶质的含量较少,不能吸收大量的CO2.所以要除去CO中混有较多的CO2,通常用NaOH溶液而不用Ca(OH)2溶液。故填:小;
(3)氢氧化钠与氯化钙也会形成的微溶于水的氢氧化钙,会有白色沉淀,化学方程式为:CaCl2+2NaOH=Ca(OH)2↓+2NaCl;故填:CaCl2+2NaOH=Ca(OH)2↓+2NaCl;
(4)实验二通过两只试管中的现象对比,可以判断稀盐酸与碱能反应,该实验选取不溶于水或微溶于水的碱,现象更明显,故填:BC。

【题目】在一密闭容器内有X、Y、Z、W四种物质,反应--段时间后,测得反应前后各物质的质量如下表所示,则下列说法中不正确的是
物质 | X | Y | Z | W |
反应前质量/g | 28 | 3 | 20 | 4 |
反应后质量/g | a | 3 | 12 | 26 |
A.a等于14
B.Y一定是催化剂
C.参与反应的X与反应生成的W的质量比是7:11
D.若继续反应至反应停止后,还要消耗8 g的Z