题目内容
某矿井采出的食盐(俗称井盐)中含有CaCl2,为设计除杂方案需测定CaCl2的含量;取上述井盐22.8g,向其中加入100g质量分数为10.6%的Na2CO3溶液恰好完全反应.若样品检测过程在10℃的恒温下进行,此时NaCl的溶解度为36g.
(1)取样检测后的溶液中,Na+与Cl-的数量比为______.
(2)求检测后的溶液中NaCl的质量及井盐中CaCl2的质量分数(结果保留一位小数).
(3)请通过相关计算判断,取样检测后的溶液是否为t℃时的NaCl饱和溶液?
解:(1)恰好完全反应后的溶液为氯化钠溶液,因此溶液中Na+与Cl-的数量比为1:1;
故答案为:1:1;
(2)设井盐样品中氯化钙的质量为x,反应生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 117
x 100g×10.6% y
 =
=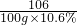 =
=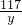
x=11.1g,y=11.7g
检测后的溶液中NaCl的质量=(22.8g-11.1g)+11.7g=23.4g,井盐中CaCl2的质量分数= ×100%≈48.7%;
×100%≈48.7%;
(3)设恰好完全反应时生成碳酸钙沉淀的质量为z
CaCl2+Na2CO3═2NaCl+CaCO3↓
106 100
100g×10.6% z
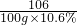 =
= z=10g
z=10g
则取样检测后的溶液质量=22.8g+100g-10g=112.8g,此时溶液中水的质量=112.8g-23.4g=89.4g
23.4g氯化钠在10℃形成饱和溶液时需要水的质量= ×100g=65g
×100g=65g
∵89.4g>65g∴取样检测后的溶液为此时氯化钠的不饱和溶液
答:(2)检测后的溶液中NaCl的质量为23.4g,井盐中CaCl2的质量分数为48.7%;(3)取样检测后的溶液为该温度下氯化钠的未饱和溶液.
分析:(1)氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,因此恰好完全反应后的溶液为氯化钠溶液,该溶液中Na+与Cl-的数量相等;
(2)检测后的溶液中NaCl的质量不井盐样品中氯化钠质量与反应生成氯化钠质量和,因此根据反应的化学方程式,由碳酸钠的质量计算出氯化钙质量及生成的氯化钠的质量,即可解决检测后的溶液中NaCl的质量及井盐中CaCl2的质量分数;
(3)将检测后溶液的溶质氯化钠的质量与溶液质量关系与此温度下饱和氯化钠溶液相对比,可判断此时的溶液是否为氯化钠的饱和溶液.
点评:根据质量守恒定律,取样检测后所得溶液的质量=所取井盐样品的质量+所加碳酸钠溶液的质量-生成沉淀碳酸钙的质量.
故答案为:1:1;
(2)设井盐样品中氯化钙的质量为x,反应生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 117
x 100g×10.6% y
 =
=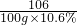 =
=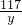
x=11.1g,y=11.7g
检测后的溶液中NaCl的质量=(22.8g-11.1g)+11.7g=23.4g,井盐中CaCl2的质量分数=
 ×100%≈48.7%;
×100%≈48.7%;(3)设恰好完全反应时生成碳酸钙沉淀的质量为z
CaCl2+Na2CO3═2NaCl+CaCO3↓
106 100
100g×10.6% z
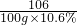 =
= z=10g
z=10g则取样检测后的溶液质量=22.8g+100g-10g=112.8g,此时溶液中水的质量=112.8g-23.4g=89.4g
23.4g氯化钠在10℃形成饱和溶液时需要水的质量=
 ×100g=65g
×100g=65g∵89.4g>65g∴取样检测后的溶液为此时氯化钠的不饱和溶液
答:(2)检测后的溶液中NaCl的质量为23.4g,井盐中CaCl2的质量分数为48.7%;(3)取样检测后的溶液为该温度下氯化钠的未饱和溶液.
分析:(1)氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,因此恰好完全反应后的溶液为氯化钠溶液,该溶液中Na+与Cl-的数量相等;
(2)检测后的溶液中NaCl的质量不井盐样品中氯化钠质量与反应生成氯化钠质量和,因此根据反应的化学方程式,由碳酸钠的质量计算出氯化钙质量及生成的氯化钠的质量,即可解决检测后的溶液中NaCl的质量及井盐中CaCl2的质量分数;
(3)将检测后溶液的溶质氯化钠的质量与溶液质量关系与此温度下饱和氯化钠溶液相对比,可判断此时的溶液是否为氯化钠的饱和溶液.
点评:根据质量守恒定律,取样检测后所得溶液的质量=所取井盐样品的质量+所加碳酸钠溶液的质量-生成沉淀碳酸钙的质量.

练习册系列答案
相关题目