题目内容
根据质量守恒定律,6 g镁和8 g氧气充分反应,可生成14 g氧化镁。这种说法正确吗?为什么?如不正确,请加以改正
略
分析:根据题干信息可知,镁完全燃烧时,生成氧化镁.由它们反应的化学方程式各种物质的比例关系应用于质量守恒定律判断选项正误.
解:2Mg+O2 2MgO
2MgO
2×24 32 68
由于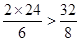 ,所以氧气过量。
,所以氧气过量。
设6 g镁能与氧气反应的质量为x。
2Mg+O2 2MgO
2MgO
48 32
6 g x
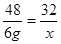 ,x="4" g
,x="4" g
生成氧化镁的质量:6 g + 4 g="10" g。
所以上述说法可以这样改正:
根据质量守恒定律,6 g镁和4 g氧气恰好完全反应后,可以生成10 g氧化镁
解:2Mg+O2
 2MgO
2MgO2×24 32 68
由于
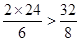 ,所以氧气过量。
,所以氧气过量。设6 g镁能与氧气反应的质量为x。
2Mg+O2
 2MgO
2MgO48 32
6 g x
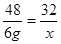 ,x="4" g
,x="4" g生成氧化镁的质量:6 g + 4 g="10" g。
所以上述说法可以这样改正:
根据质量守恒定律,6 g镁和4 g氧气恰好完全反应后,可以生成10 g氧化镁

练习册系列答案
相关题目