题目内容
将CO通入盛有12 g Fe2O3的试管内,加热反应一段时间后,停止加热,继续通入CO至试管冷却,此时试管内残留固体的质量为9.6g,则反应生成铁的质量为 ( )
| A.2.4 g | B.5.6 g | C.8.4 g | D.11.4g |
B
解析试题分析:参加反应的氧化铁中氧元素的质量为12g-9.6g=2.4g;所以参加反应氧化铁的质量为2.4g÷(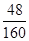 ×100%)=8g;即生成铁的质量为8g-2.4g=5.6g
×100%)=8g;即生成铁的质量为8g-2.4g=5.6g
考点:高炉炼铁的反应原理;差量法计算;元素质量=物质质量×物质中元素的质量分数

练习册系列答案
相关题目
下列各物质均含有N元素,在这些物质中N元素的化合价最低的一种是
| A.KNO3 | B.NH4Cl | C.NO | D.NO2 |
煅烧石灰石可制得氧化钙(假设石灰石中的杂质不参与反应,且不含钙、碳元素).测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3.则已分解的碳酸钙占原碳酸钙的质量分数为( )
| A.40% | B.60% | C.30% | D.50% |
下列化学方程式正确的是( )
| A.3Fe+2AlCl3=3FeCl3+2Al | B.3Cu+2AlCl3=3CuCl2+2Al |
| C.Fe+CuCl2=FeCl2+Cu | D.2Fe+3H2SO4=Fe2(SO4)3+3H2↑ |
化学反应前后可能发生变化的是( )
| A.分子数目 | B.元素种类 | C.原子数目 | D.物质的总质量 |
下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是
| A.H | B.Fe | C.N2 | D.H2O |
在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示:下列说法正确的是( )
| A.丙可能是单质 |
| B.在该反应中丁一定没有参加化学反应 |
| C.该反应是化合反应 |
| D.甲和乙的质量之和一定等于生成丙的质量 |
某绿色能源X,其燃烧的化学方程式:X+3O2 2CO2+3H2O,根据质量守恒定律判断X的化学式为( )
2CO2+3H2O,根据质量守恒定律判断X的化学式为( )
| A.H2 | B.CH4 | C.CH3OH | D.C2H5OH |