题目内容
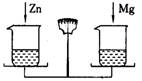
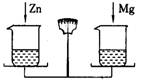
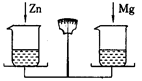
在天平的两个托盘上分别放等质量的烧杯,杯内加入质量相等的足量稀H2SO4,往左烧杯里加入0.44克CaO,要使天平重新平衡,可往右烧杯加入的适宜物质是
- A.0.48gMg粉
- B.1.00gCaCO3
- C.2gMgCO3
- D.0.44gCu、Al混合粉末
A
分析:本题是有关天平平衡问题.天平要在反应后保持平衡,必须满足反应后两个烧杯中剩余物质质量相等.
可写出化学方程式,求出逸出气体的质量,再利用差量法求出烧杯中剩余物质质量,进行分析比较作答.
解答:因为在反应前两个烧杯中的稀硫酸溶液质量相等,所以要使反应后两个烧杯中剩余物质质量之和相等.
具体分析左盘烧杯中物质在反应后质量的变化,因为硫酸和氧化钙反应有没有物质逸出,故左盘烧杯中物质质量增加0.44克.
A、加入0.48克镁,根据化学方程式可计算生成氢气质量为0.04克,溶液质量增加0.48-0.04=0.44克,所以天平平衡
B、加入1.00g碳酸钙,因为碳酸钙和硫酸不能完全反应,假设碳酸钙可以和硫酸反应,那么根据化学方程式可计算最多放出CO2气体的质量为0.44,此时烧杯中物质的质量最少为1-0.44=0.56>0.44g,所以天平不会平衡.
C、加入2克碳酸镁,那么根据化学方程式可计算最多放出CO2气体的质量为1.1克,此时烧杯中物质的质量为2-1.1=0.9>0.44g,天平不平衡.
D、加入0.44g铜铝混合物,假设全部位铜,由于铜不合硫酸反应,没有气体逸出,所以天平平衡;假设全部为铝,要放出气体,那么剩余烧杯中物质的质量将小于0.44g,天平不平衡;所以如果是混合物,烧杯中剩余物质质量也是小于0.44克,天平不会平衡.
故选A
点评:解决天平平衡题或是天平偏向问题,主要就是比较反应前后烧杯中剩余物质的质量变化量,因为计算的是反应后烧杯中物质的总质量变化,所以常用差量法进行比较.
分析:本题是有关天平平衡问题.天平要在反应后保持平衡,必须满足反应后两个烧杯中剩余物质质量相等.
可写出化学方程式,求出逸出气体的质量,再利用差量法求出烧杯中剩余物质质量,进行分析比较作答.
解答:因为在反应前两个烧杯中的稀硫酸溶液质量相等,所以要使反应后两个烧杯中剩余物质质量之和相等.
具体分析左盘烧杯中物质在反应后质量的变化,因为硫酸和氧化钙反应有没有物质逸出,故左盘烧杯中物质质量增加0.44克.
A、加入0.48克镁,根据化学方程式可计算生成氢气质量为0.04克,溶液质量增加0.48-0.04=0.44克,所以天平平衡
B、加入1.00g碳酸钙,因为碳酸钙和硫酸不能完全反应,假设碳酸钙可以和硫酸反应,那么根据化学方程式可计算最多放出CO2气体的质量为0.44,此时烧杯中物质的质量最少为1-0.44=0.56>0.44g,所以天平不会平衡.
C、加入2克碳酸镁,那么根据化学方程式可计算最多放出CO2气体的质量为1.1克,此时烧杯中物质的质量为2-1.1=0.9>0.44g,天平不平衡.
D、加入0.44g铜铝混合物,假设全部位铜,由于铜不合硫酸反应,没有气体逸出,所以天平平衡;假设全部为铝,要放出气体,那么剩余烧杯中物质的质量将小于0.44g,天平不平衡;所以如果是混合物,烧杯中剩余物质质量也是小于0.44克,天平不会平衡.
故选A
点评:解决天平平衡题或是天平偏向问题,主要就是比较反应前后烧杯中剩余物质的质量变化量,因为计算的是反应后烧杯中物质的总质量变化,所以常用差量法进行比较.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
在托盘天平的两个托盘上各放一只烧杯,分别注入相同质量分数、相同质量的稀盐酸,天平平衡。向左边的烧杯中加入1 0 g金属锌,向右边的烧杯中加入1 0 g金属镁。当反应停止后,金属都有剩余,天平指针的指向是
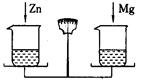

| A.分度盘的左边 |
| B.分度盘的中间 |
| C.分度盘的右边 |
| D.3种情况都有可能 |
在托盘天平的两个托盘上各放一只烧杯,分别注入相同质量分数、相同质量的稀盐酸,天平平衡。向左边的烧杯中加入1 0 g金属锌,向右边的烧杯中加入1 0 g金属镁。当反应停止后,金属都有剩余,天平指针的指向是
| A.分度盘的左边 |
| B.分度盘的中间 |
| C.分度盘的右边 |
| D.3种情况都有可能 |