题目内容
 21、A、B两种固体物质的溶解度曲线如图所示.请回答:
21、A、B两种固体物质的溶解度曲线如图所示.请回答:(1)
t2
℃时,A、B两种物质的溶解度相同;(2)我国有些地区有一种说法:“冬天捞碱,夏天晒盐”.这里的碱是指Na2CO3,盐是指NaCl.那么,图中
A
(填A或B)的溶解度曲线与Na2CO3的溶解度曲线相似.(3)人们用上述方法从盐湖中捞得的Na2CO3(常含有少量的NaCl).试计算Na2CO3的摩尔质量为
106
g/mol,2mol Na2CO3中约含有1.204×1024
个碳原子.(4)某研究性学习小组对捞得的碱进行分析,称取Na2CO3固体(含少量的NaCl)样品12.5g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到0.1mol CO2气体.该反应的化学方程式为
2HCl+Na2CO3→2NaCl+H2O+CO2↑
,上述样品中含Na2CO3的物质的量为0.1mol
mol,质量为10.6g
g.分析:由溶解度曲线可以:比较同一温度时,两种物质的溶解度大小;根据生活现象分析物质的溶解度的特点,找出与之相对应的溶解度曲线.由摩尔质量的概念可以计算出Na2CO3的摩尔质量;根据化学方程式可以计算出样品中含Na2CO3的物质的量.
解答:解:(1)t2℃时,A、B两种物质的溶解度交于一点,故它们的溶解度相同;
(2))“冬天捞碱,夏天晒盐”,碳酸钠在冬天从水中析出,说明碳酸钠的溶解度受温度影响比较大,与图中曲线A相似.
(3)Na2CO3的摩尔质量为:23×2+12+16×3=106g/mol,1mol中含有 6.22×1023个原子,2mol Na2CO3中约含有碳原子的数目为1.204×1024
(4)反应的化学方程式为:2HCl+Na2CO3→2NaCl+H2O+CO2↑,共收集到0.1mol CO2气体,则参加反应的Na2CO3的物质的量也为0.1mol,质量为0.1mol×106g/mol=10.6g
故答案为:(1)t2
(2)A
(3)106,1.204×1024
(4)2HCl+Na2CO3→2NaCl+H2O+CO2↑;0.1mol;10.6g
(2))“冬天捞碱,夏天晒盐”,碳酸钠在冬天从水中析出,说明碳酸钠的溶解度受温度影响比较大,与图中曲线A相似.
(3)Na2CO3的摩尔质量为:23×2+12+16×3=106g/mol,1mol中含有 6.22×1023个原子,2mol Na2CO3中约含有碳原子的数目为1.204×1024
(4)反应的化学方程式为:2HCl+Na2CO3→2NaCl+H2O+CO2↑,共收集到0.1mol CO2气体,则参加反应的Na2CO3的物质的量也为0.1mol,质量为0.1mol×106g/mol=10.6g
故答案为:(1)t2
(2)A
(3)106,1.204×1024
(4)2HCl+Na2CO3→2NaCl+H2O+CO2↑;0.1mol;10.6g
点评:本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 22、右图为A、B两种固体物质的溶解度曲线请回答:
22、右图为A、B两种固体物质的溶解度曲线请回答: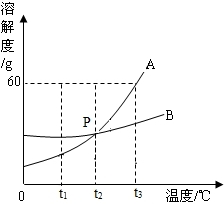 如图是A、B两种固体物质的溶解度曲线:
如图是A、B两种固体物质的溶解度曲线: (2013?建宁县质检)A、B两种固体物质的溶解度曲线如图所示:
(2013?建宁县质检)A、B两种固体物质的溶解度曲线如图所示: (2006?平谷区一模)(1)如图为a、b两种固体物质的溶解度曲线.
(2006?平谷区一模)(1)如图为a、b两种固体物质的溶解度曲线. (2012?金山区一模)如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是 ( )
(2012?金山区一模)如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是 ( )