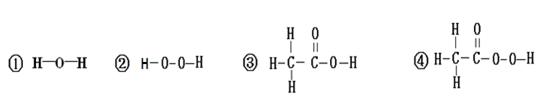
题目内容
纯净物的化学式是经实验测定得出的。同学们设计以下甲、乙两组实验方案测定水的组成。

(1)甲方案中发生反应的化学方程式为 ,b端的气体是 。由产生气体的体积可推算出氢气与氧气的质量比为1:8,若氢、氧元素的相对原子质量分别为m和n,则水中氢、氧元素的原子个数比为 (用“m”或“n”表示)。
(2)乙方案的实验过程中,B装置中可观察到 。若反应结束测得B装置减轻1.6g,则C装置增重的质量会 (填“大于”、“等于”或“小于”)1.8g。甲、乙方案的反应原理虽不同,但实验的设计依据都是 。

(1)甲方案中发生反应的化学方程式为 ,b端的气体是 。由产生气体的体积可推算出氢气与氧气的质量比为1:8,若氢、氧元素的相对原子质量分别为m和n,则水中氢、氧元素的原子个数比为 (用“m”或“n”表示)。
(2)乙方案的实验过程中,B装置中可观察到 。若反应结束测得B装置减轻1.6g,则C装置增重的质量会 (填“大于”、“等于”或“小于”)1.8g。甲、乙方案的反应原理虽不同,但实验的设计依据都是 。
(1)2H2O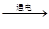 2H2↑+O2↑,H2,
2H2↑+O2↑,H2,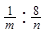 (n:8m)
(n:8m)
(2)黑色固体变红色,大于,化学反应前后元素的质量、种类均不变
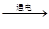 2H2↑+O2↑,H2,
2H2↑+O2↑,H2,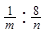 (n:8m)
(n:8m)(2)黑色固体变红色,大于,化学反应前后元素的质量、种类均不变
试题分析:(1)甲方案电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,若气体不纯,可能会发出爆鸣声;正负两极气体的体积比为1:2 ,质量比为8:1 ,该实验能得出水是由氢元素和氧元素组成的结论;原子的质量可以用相对原子质量表示,那么水中氢、氧元素的原子个数比为
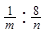 ;
;(2)锌和稀硫酸反应生成氢气,氢气具有还原性,能把氧化铜还原成铜,现象是黑色的粉末变成红色;若反应结束测得B装置减轻1.6g,即氧化铜中氧元素的质量为1.6g,那么C装置增重的质量即水的质量大于1.8g;它们实验的设计依据都是质量守恒定律:化学反应前后元素的质量、种类均不变。

练习册系列答案
相关题目