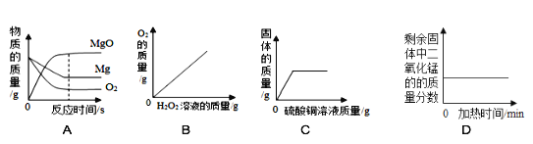
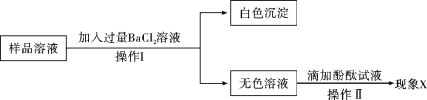
题目内容
【题目】某同学用铁和碳的合金样品做了如下实验:称量11.4g样品,放入质量为40g的烧杯中,再往烧杯中加入100g稀硫酸,有气泡产生,充分反应后,又加入50g稀硫酸,无明显现象。反应完毕后称量,烧杯及烧杯内物质总质量为201g。已知:生铁含碳量为2%~4.3%,钢的含碳量为0.03%~2%。求:
(1)反应产生的氢气质量为_____g;
(2)判断此铁碳合金属于生铁还是钢_____(写出计算过程,结果保留到0.1%)?
【答案】0.4 钢
【解析】
合金样品中的铁与稀硫酸反应生成氢气,反应在烧杯中进行,生成的氢气逸散到空气中去了,反应后烧杯中减少的质量是生成氢气的质量。
(1)根据质量守恒定律,生成氢气的质量为:11.4g+40g+100g+50g-201g=0.4g;
(2)设合金样品中铁的质量为x

![]() ,解得x=11.2g
,解得x=11.2g
合金样品中含碳量为:![]() ≈1.8%
≈1.8%
0.03%<1.8%<2%,所以该合金样品属于钢。

练习册系列答案
相关题目