题目内容
比较氧化亚铁、氧化铁、四氧化三铁中含铁量的高低,回答下面的问题:
(1)按含铁量由高到低的顺序排列是:________.(写化学式)
(2)100克FeO中的含铁质量跟________克Fe2O3,________克Fe3O4中的含铁的质量一样多.
解:(1)氧化亚铁、氧化铁、四氧化三铁都是由铁元素和氧元素组成的,在这三种化合物中铁元素和氧元素的原子个数比分别为:
FeO:1:1;
Fe2O3:2:3;
Fe3O4:3:4;
由原子个数比可知,铁原子个数比值大的含铁量高,1:1>3:4>2:3,故FeO>Fe3O4>Fe2O3;
(2)设与100克FeO中的含铁质量相等的Fe2O3和Fe3O4的质量分别为x、y
则100g×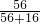 =x×
=x×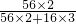 =y×
=y×
解得x=111g,y=107g
故答案为:(1)FeO>Fe3O4>Fe2O3 (2)111g 107g
分析:(1)根据氧化亚铁、氧化铁、四氧化三铁都是由铁元素和氧元素组成的,铁原子个数比值大的含铁量高进行分析;
(2)根据元素的质量等于化合物的质量乘以元素的质量分数进行分析.
点评:本题难度较大,考查学生根据灵活运用化学式的有关计算进行分析问题、解决问题的能力.
FeO:1:1;
Fe2O3:2:3;
Fe3O4:3:4;
由原子个数比可知,铁原子个数比值大的含铁量高,1:1>3:4>2:3,故FeO>Fe3O4>Fe2O3;
(2)设与100克FeO中的含铁质量相等的Fe2O3和Fe3O4的质量分别为x、y
则100g×
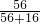 =x×
=x×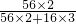 =y×
=y×
解得x=111g,y=107g
故答案为:(1)FeO>Fe3O4>Fe2O3 (2)111g 107g
分析:(1)根据氧化亚铁、氧化铁、四氧化三铁都是由铁元素和氧元素组成的,铁原子个数比值大的含铁量高进行分析;
(2)根据元素的质量等于化合物的质量乘以元素的质量分数进行分析.
点评:本题难度较大,考查学生根据灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目