题目内容
现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:| 反应时间/s | 20 | 20 | 20 | 20 | 20 | 20 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
(1)样品中碳酸钙的质量分数.(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数.
【答案】分析:(1)根据题意,石灰石样品中碳酸钙与盐酸反应生成了二氧化碳,质量减少,通过第100~120秒的烧杯及所盛物质质量对比分析,到第100分钟秒反应已停止,由此根据质量守恒定律,烧杯中减少的质量就是生成的二氧化碳的质量,进而求出碳酸钙的质量;
(2)根据反应的方程式,由二氧化碳的质量还可以氯化钙的质量,最后求出完全反应后溶液中氯化钙的质量分数.
解答:解:根据质量守恒定律,可得出反应生成的CO2 质量为:15g+105.4g-116g=4.4g
设:反应生成的氯化钙质量为x,碳酸钙质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
y x 4.4g
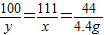
x=11.1g y=10g
(1)样品中碳酸钙的质量分数为: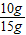 ×100%≈66.7%
×100%≈66.7%
(2)样品中杂质的质量为:15g-10g=5g,则反应后溶液质量为:116g-5g=111g
反应后溶液中氯化钙的质量分数为: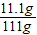 ×100%=10%
×100%=10%
答:(1)样品中碳酸钙的质量分数约为66.7%;(2)完全反应后溶液中氯化钙的质量分数10%.
点评:解答本题的关键是根据质量守恒定律,准确判断出二氧化碳和反应后生成的溶液的质量.
(2)根据反应的方程式,由二氧化碳的质量还可以氯化钙的质量,最后求出完全反应后溶液中氯化钙的质量分数.
解答:解:根据质量守恒定律,可得出反应生成的CO2 质量为:15g+105.4g-116g=4.4g
设:反应生成的氯化钙质量为x,碳酸钙质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
y x 4.4g
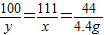
x=11.1g y=10g
(1)样品中碳酸钙的质量分数为:
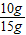 ×100%≈66.7%
×100%≈66.7%(2)样品中杂质的质量为:15g-10g=5g,则反应后溶液质量为:116g-5g=111g
反应后溶液中氯化钙的质量分数为:
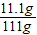 ×100%=10%
×100%=10%答:(1)样品中碳酸钙的质量分数约为66.7%;(2)完全反应后溶液中氯化钙的质量分数10%.
点评:解答本题的关键是根据质量守恒定律,准确判断出二氧化碳和反应后生成的溶液的质量.

练习册系列答案
相关题目
(2011年贵州安顺,14题)现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:
| 反应时间/s | 20 | 20 | 20 | 20 | 20 | 20 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
请计算回答:(1)样品中碳酸钙的质量分数。(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数。
(2011年贵州安顺,14题)现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:
| 反应时间/s | 20 | 20 | 20 | 20 | 20 | 20 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
请计算回答:(1)样品中碳酸钙的质量分数。(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数。
现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与烧杯内物质的质量变化如下表所示:
请计算回答:样品中碳酸钙的质量分数.(计算结果保留到0.1%)
| 反应时间/s | 20 | 40 | 60 | 80 | 100 | 120 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |