题目内容
(2009?顺德区模拟)将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:(1)写出滴加过程中发生反应的化学方程式:______.
(2)当CaCl2和Na2CO3恰好完全反应时,消耗Na2CO3溶液的质量为______g.得到沉淀的质量为______g.
(3)当混合溶液中的CaCl2和Na2CO3恰好完全反应后,过滤,求所得溶液中溶质的质量分数为多少?(可能用到的相对分子质量:CaCl2-111;Na2CO3-106;NaCl-58.5)

【答案】分析:(1)根据固体的成分可知,氯化钙能与碳酸钠溶液发生复分解反应生成碳酸钙沉淀和氯化钠;
(2)根据图可知,加50g碳酸钠溶液时得到溶液为100g,则生成沉淀的质量为50g+60g-100g=10g,然后再加碳酸钠溶液时溶液质量不发生变化,即确定加50g碳酸钠溶液时氯化钙和碳酸钠恰好完全反应;
(3)根据10g碳酸钙的质量代入化学反应方程式进行计算生成的氯化钠的质量,再计算溶质的质量分数.
解答:解:(1)因碳酸钠与氯化钙反应生成碳酸钙和氯化钠,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)由图可知,加50g溶液时50g+60g≠100g,则有10g沉淀生成,当再继续加20g溶液时溶液质量等于二者的加和,即加50g溶液恰好完全反应,故答案为:50;10;
(3)设反应生成的氯化钠的质量为x,混合物中氯化钙的质量为y,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100 117
y 10g x
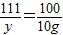 ,
,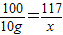
解得x=11.7g,y=11.1g;
则NaCl总质量为11.7g+(14.4g-11.1g)=15g;
恰好反应时得到溶液的质量为100g,
所得溶液中溶质的质量分数为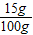 ×100%=15%,
×100%=15%,
答所得溶液中溶质的质量分数为15%.
点评:本题较难,考查学生利用化学反应方程式的计算,但数据的使用应来源于学生对反应时的质量关系图的分析,考查了学生的很强的能力.
(2)根据图可知,加50g碳酸钠溶液时得到溶液为100g,则生成沉淀的质量为50g+60g-100g=10g,然后再加碳酸钠溶液时溶液质量不发生变化,即确定加50g碳酸钠溶液时氯化钙和碳酸钠恰好完全反应;
(3)根据10g碳酸钙的质量代入化学反应方程式进行计算生成的氯化钠的质量,再计算溶质的质量分数.
解答:解:(1)因碳酸钠与氯化钙反应生成碳酸钙和氯化钠,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)由图可知,加50g溶液时50g+60g≠100g,则有10g沉淀生成,当再继续加20g溶液时溶液质量等于二者的加和,即加50g溶液恰好完全反应,故答案为:50;10;
(3)设反应生成的氯化钠的质量为x,混合物中氯化钙的质量为y,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100 117
y 10g x
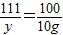 ,
,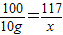
解得x=11.7g,y=11.1g;
则NaCl总质量为11.7g+(14.4g-11.1g)=15g;
恰好反应时得到溶液的质量为100g,
所得溶液中溶质的质量分数为
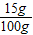 ×100%=15%,
×100%=15%,答所得溶液中溶质的质量分数为15%.
点评:本题较难,考查学生利用化学反应方程式的计算,但数据的使用应来源于学生对反应时的质量关系图的分析,考查了学生的很强的能力.

练习册系列答案
相关题目
 (2009?顺德区模拟)如图是A物质的溶解度曲线图,下表是B物质在不同温度时的溶解度.
(2009?顺德区模拟)如图是A物质的溶解度曲线图,下表是B物质在不同温度时的溶解度.| 温度/℃ | 20 | 40 | 60 | 80 | |
| B物质溶解度/g | 32 | 35 | 40 | 45 | 55 |
(2)℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为同学的方法合理.
(4)40℃时,要使240g A物质M点的溶液变成该温度下的饱和溶液,需要加A的质量为g.