题目内容
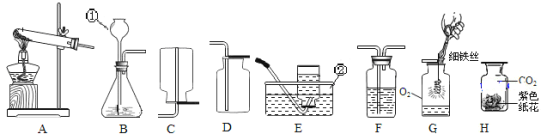
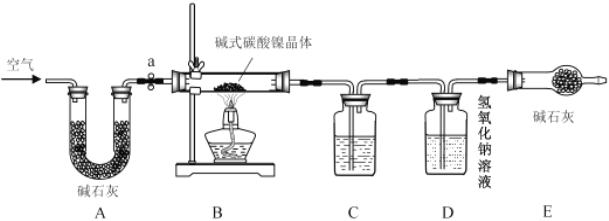
【题目】为测定碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)组成,某小组设计了如下实验方案及装置:
(资料卡片)
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(实验步骤)
①检查装置气密性;
②准确称取mg碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;
④关闭弹簧夹a,加热装置B至反应完全;
⑤……
⑥分别准确称量装置C、D、E的质量;回答下列问题:(假充每一步均反应完全)
(1)装置C中所装药品为_____。
(2)装置D中发生反应的化学方程式为_____。
(3)证明装置B中碱式碳酸镍晶体已反应完全的现象是_____。
(4)⑤应填写的操作是_____。
(5)实验反思:实验步骤不变,若没有装置E,会导致碱式碳酸镍晶体组成中y的数值_____(填“偏大”“偏小”或“无法判断”)。
【答案】浓硫酸 CO2+2NaOH=H2O+Na2CO3 B装置的质量不再变化 打开弹簧夹a,鼓入一段时间空气 偏小
【解析】
(1)因为碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O;分别称量装置C、D、E的质量;可知算出其生成物的质量,C装置用来吸收生成的水分,采用的是浓硫酸来做干燥剂,D装置用来吸收二氧化碳的;故填:浓硫酸
(2)装置D中发生的反应为:CO2+2NaOH=H2O+Na2CO3;
(3)加热装置B至反应完全,当装置B的质量不再变化时,证明装置B中碱式碳酸镍晶体已反应完全;故填: B装置的质量不再变化;
(4)⑤应填写的操作是:打开弹簧夹a,鼓入一段时间空气,使得装置内的水蒸气和二氧化碳全部被吸收。故填:打开弹簧夹a,鼓入一段时间空气;
(5)实验反思:实验步骤不变,若没有装置E,则空气中的水和二氧化碳会被装置D吸收,使得称量的二氧化碳的质量增大,导致碳酸根的比例比原来增大,而使得水和Ni(OH)2所得的比例减少,故计算时会导致碱式碳酸镍晶体组成中y的数值偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案