题目内容
有两片质量相等的锌片,使其中一片跟足量的稀硫酸起反应,另一片先煅烧成氧化锌,然后也跟足量的稀硫酸起反应.用两种方法制得的硫酸锌的质量( )
【答案】分析:由两个反应的化学方程式分析,依据质量守恒定律,反应前后元素的质量不变,再根据元素质量分数的计算公式进行比较分析,得出答案.
解答:解:因为锌片的质量相等,由锌元素的质量分数可得其中锌元素的质量也相等.由两个化学方程式Zn+H2SO4=ZnSO4+H2↑、2Zn+O2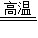 2ZnO和ZnO+H2SO4=ZnSO4+H2O
2ZnO和ZnO+H2SO4=ZnSO4+H2O
可以看出,硫酸锌中的锌元素全部是由锌片反应而来,根据质量守恒定律中元素质量在反应前后不变,则生成的硫酸锌中的锌元素也相等,由硫酸锌中锌元素的质量分数可得,两份硫酸锌的质量也相等.
故选C.
点评:该题考查的是质量守恒定律,若用元素守恒法,则无需计算,能迅速获得答案.
解答:解:因为锌片的质量相等,由锌元素的质量分数可得其中锌元素的质量也相等.由两个化学方程式Zn+H2SO4=ZnSO4+H2↑、2Zn+O2
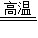 2ZnO和ZnO+H2SO4=ZnSO4+H2O
2ZnO和ZnO+H2SO4=ZnSO4+H2O可以看出,硫酸锌中的锌元素全部是由锌片反应而来,根据质量守恒定律中元素质量在反应前后不变,则生成的硫酸锌中的锌元素也相等,由硫酸锌中锌元素的质量分数可得,两份硫酸锌的质量也相等.
故选C.
点评:该题考查的是质量守恒定律,若用元素守恒法,则无需计算,能迅速获得答案.

练习册系列答案
相关题目
有两片质量相等的锌片,使其中一片跟足量的稀硫酸起反应,另一片先煅烧成氧化锌,然后也跟足量的稀硫酸起反应.用两种方法制得的硫酸锌的质量( )
| A、第一种方法制得的硫酸锌的质量大 | B、第二种方法制得的硫酸锌的质量大 | C、相等 | D、不易比较 |