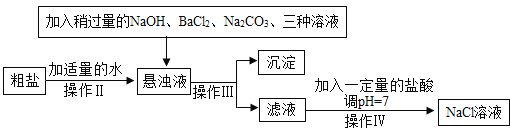
题目内容
【题目】在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
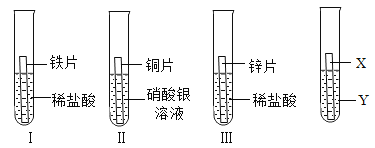
(1)一段时间后,可观察到实验Ⅱ现象是_________________;反应的化学方程式是________________________。
(2)甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱。你认为他依据的实验现象是________________________。
(3)乙和丙两位同学认为上述三个实验不能够得出四种金属活动性顺序,原因是________________________;并在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。
他们的实验:X是金属Fe,Y是______________(写出化学式)溶液。
【答案】 铜片表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3===2Ag+Cu(NO3)2 锌与酸反应的程度要比铁的剧烈 无法比较铁与铜的活动性 CuSO4[或CuCl2、Cu(NO3)2等]
【解析】根据所学知识和题中信息知,(1)一段时间后,可观察到实验Ⅱ现象是铜片表面有银白色固体析出,溶液由无色变为蓝色,铜比银活泼,可以把银置换出来;反应的化学方程式是Cu+2AgNO3=2Ag+Cu(NO3)2。(2) 通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱。依据的实验现象是锌与酸反应的程度要比铁的剧烈,产生的气泡快又多。(3) 上述三个实验不能够得出四种金属活动性顺序,原因是无法比较铁与铜的活动性;并在上述实验的基础上,补充实验:X是金属Fe,Y是CuSO4[或CuCl2、Cu(NO3)2等] 溶液,铁可以把铜置换出来,证明铁比铜活泼。
点睛∶在金属活动顺序表中①氢前面金属可以与稀盐酸或稀硫酸反应,置换出氢气,氢后面金属则不可以。②从左到右越来越不活泼。③前面金属可以把其后面金属从他的盐溶液中置换出来,活泼的置换不活泼的。