题目内容
 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.
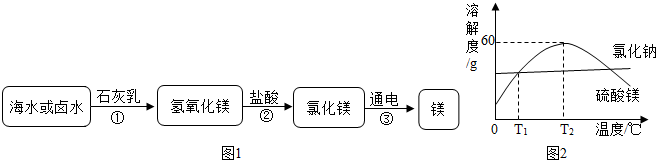
海水中的MgCl2熟石灰过滤Mg(OH)2蒸发、浓缩、结晶MgCl2?6H2O脱水MgCl2通电Mg
(1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
①在实验室进行过滤操作时需要用到玻璃棒,其作用是______.
②电解熔融氯化镁的过程中,______能转化为______能.
③写出氯化镁与熟石灰反应的化学方程式______.
(2)①取两块大小相同的干冰,在干冰中央挖一个小穴,撒入一些镁粉,用红热的铁棒把镁点燃,将另一块干冰盖上,你会看到镁粉在干冰内继续燃烧,发出耀眼的白光,像冰灯一样.已知该反应的生成物是氧化镁和碳.此反应的方程式是______,此反应属于______反应(判断基本反应类型).该实验证明干冰具有______的性质(答一条即可);为验证上述反应所得固体中无剩余镁,可向该固体中加入试剂得名称为______,反应的现象是______.②金属镁在高温下与氮气反应生成氮化镁,氮化镁中氮元素的化合价-3.据此写出氮化镁的化学式______.
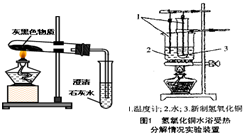
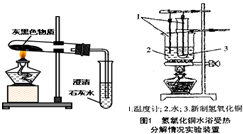
(3)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属.但拿出的镁条总是有一层灰黑色,这层灰黑色是什么物质呢?
猜想:小明认为可能是MgO;小赵认为可能是Mg2(OH)2CO3;小花认为可能是Mg(OH)2.小赵认为小明的猜想是错误的,其理由是______.
实验探究:小赵按右图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体.实验分析:实验后,小赵认为小花的猜测也是错误的,其理由______.
查阅资料得出结论:Mg(OH)2和Mg2(OH)2CO3都可以加热分解,产物均为氧化物,请写出Mg2(OH)2CO3加热分解的化学方程式_____________..
(4)镁铝合金广泛用于火箭、导弹和飞机制造业等.某兴趣小组为探究镁铝合金的组成,取16g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中(只有铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁与氢氧化钠溶液不反应),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
解:(1)①在过滤操作中要用到玻璃棒,它起的作用是引流,故答案为:引流;
②电解熔融的氯化镁的过程是把电能转化为化学能,故答案为:电;化学;
③氯化镁与熟石灰反应生成氢氧化镁沉淀和氯化钙,用观察法配平,所以方程式是:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(2)①反应物是镁和二氧化碳,生成物是氧化镁和碳,用观察法配平,反应条件是点燃,所以方程式是:2Mg+CO2 2MgO+C;一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应;该实验证明干冰在点燃条件下能与镁反应生成氧化镁和碳,稀盐酸或稀硫酸可以验证上述反应所得固体中有无剩余镁,因为镁能和稀盐酸或稀硫酸反应生成氢气,如果有会产生气泡;②根据正价在前,负价在后,十字交叉再约简,所以化学式是:
2MgO+C;一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应;该实验证明干冰在点燃条件下能与镁反应生成氧化镁和碳,稀盐酸或稀硫酸可以验证上述反应所得固体中有无剩余镁,因为镁能和稀盐酸或稀硫酸反应生成氢气,如果有会产生气泡;②根据正价在前,负价在后,十字交叉再约简,所以化学式是:
Mg3N2;
(3)解:猜想:氧化镁通常为白色固体与镁表面呈灰色的现实不相符,因此猜想不成立;故答案为:因为氧化镁通常为白色固体;
实验分析:实验中观察到澄清石灰水变浑浊,说明灰黑色物质分解出二氧化碳气体,则物质中含有C元素,而猜想的氢氧化镁在组成元素上不含C元素,因此猜想不成立;故答案为:石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;
查阅资料得出结论:Mg2(OH)2C03加热分解的产生均为氧化物,则分解生成MgO、H2O、CO2三种物质,用观察法配平,反应条件是加热,所以方程式是:
Mg2(OH)2C03 2MgO+H2O+CO2↑;
2MgO+H2O+CO2↑;
(4)由图表中数据可知,该合金中镁元素质量为4g,铝元素质量为12g,镁元素与铝元素质量比是4g:12g=1:3;
设20g氢氧化钠溶液中含溶质质量为X,第一次反应消耗铝的质量为16g-10.6g=5.4g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 80
5.4g X
根据: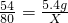 解得X=8g,所以所用氢氧化钠溶液的溶质质量分数为
解得X=8g,所以所用氢氧化钠溶液的溶质质量分数为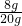 ×100%=40%.
×100%=40%.
故答案为:(1)①引流;②电;化学;③MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;(2)2Mg+CO2 2MgO+C;置换;在点燃条件下能与镁反应;稀盐酸;有气泡产生;Mg3N2;(3)氧化镁通常为白色固体;石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;
2MgO+C;置换;在点燃条件下能与镁反应;稀盐酸;有气泡产生;Mg3N2;(3)氧化镁通常为白色固体;石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;
Mg2(OH)2C03 2MgO+H2O+CO2↑;(4)1:3;40%.
2MgO+H2O+CO2↑;(4)1:3;40%.
分析:(1)①根据不同实验中玻璃棒的各种用途分析即可;②根据能量之间的相互转化分析;③根据方程式的书写方法考虑.(2)①根据方程式的书写,镁在点燃的条件下能和二氧化碳反应生成氧化镁和碳,反应类型的特点回答,镁能和稀盐酸或稀硫酸反应生成氢气,据此分析问题即可;②根据化学式的写法考虑;(3)猜想:根据物质颜色对猜想进行判断;实验分析:根据探究实验结果,对猜想进行判断;查阅资料得出结论:根据反应的特点,分析反应的生成物,完成反应化学方程式的书写;(4)根据镁与氢氧化钠溶液不反应,最后剩余固体的质量就是镁的质量,根据第一次消耗铝的质量,计算出消耗的氢氧化钠的质量,再除以20g即可.
点评:解答本题关键是要知道反应类型的判断方法,方程式的书写注意事项,知道根据方程式的简单计算技巧.
②电解熔融的氯化镁的过程是把电能转化为化学能,故答案为:电;化学;
③氯化镁与熟石灰反应生成氢氧化镁沉淀和氯化钙,用观察法配平,所以方程式是:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(2)①反应物是镁和二氧化碳,生成物是氧化镁和碳,用观察法配平,反应条件是点燃,所以方程式是:2Mg+CO2
 2MgO+C;一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应;该实验证明干冰在点燃条件下能与镁反应生成氧化镁和碳,稀盐酸或稀硫酸可以验证上述反应所得固体中有无剩余镁,因为镁能和稀盐酸或稀硫酸反应生成氢气,如果有会产生气泡;②根据正价在前,负价在后,十字交叉再约简,所以化学式是:
2MgO+C;一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应;该实验证明干冰在点燃条件下能与镁反应生成氧化镁和碳,稀盐酸或稀硫酸可以验证上述反应所得固体中有无剩余镁,因为镁能和稀盐酸或稀硫酸反应生成氢气,如果有会产生气泡;②根据正价在前,负价在后,十字交叉再约简,所以化学式是:Mg3N2;
(3)解:猜想:氧化镁通常为白色固体与镁表面呈灰色的现实不相符,因此猜想不成立;故答案为:因为氧化镁通常为白色固体;
实验分析:实验中观察到澄清石灰水变浑浊,说明灰黑色物质分解出二氧化碳气体,则物质中含有C元素,而猜想的氢氧化镁在组成元素上不含C元素,因此猜想不成立;故答案为:石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;
查阅资料得出结论:Mg2(OH)2C03加热分解的产生均为氧化物,则分解生成MgO、H2O、CO2三种物质,用观察法配平,反应条件是加热,所以方程式是:
Mg2(OH)2C03
 2MgO+H2O+CO2↑;
2MgO+H2O+CO2↑;(4)由图表中数据可知,该合金中镁元素质量为4g,铝元素质量为12g,镁元素与铝元素质量比是4g:12g=1:3;
设20g氢氧化钠溶液中含溶质质量为X,第一次反应消耗铝的质量为16g-10.6g=5.4g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 80
5.4g X
根据:
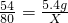 解得X=8g,所以所用氢氧化钠溶液的溶质质量分数为
解得X=8g,所以所用氢氧化钠溶液的溶质质量分数为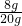 ×100%=40%.
×100%=40%.故答案为:(1)①引流;②电;化学;③MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;(2)2Mg+CO2
 2MgO+C;置换;在点燃条件下能与镁反应;稀盐酸;有气泡产生;Mg3N2;(3)氧化镁通常为白色固体;石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;
2MgO+C;置换;在点燃条件下能与镁反应;稀盐酸;有气泡产生;Mg3N2;(3)氧化镁通常为白色固体;石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素;Mg2(OH)2C03
 2MgO+H2O+CO2↑;(4)1:3;40%.
2MgO+H2O+CO2↑;(4)1:3;40%.分析:(1)①根据不同实验中玻璃棒的各种用途分析即可;②根据能量之间的相互转化分析;③根据方程式的书写方法考虑.(2)①根据方程式的书写,镁在点燃的条件下能和二氧化碳反应生成氧化镁和碳,反应类型的特点回答,镁能和稀盐酸或稀硫酸反应生成氢气,据此分析问题即可;②根据化学式的写法考虑;(3)猜想:根据物质颜色对猜想进行判断;实验分析:根据探究实验结果,对猜想进行判断;查阅资料得出结论:根据反应的特点,分析反应的生成物,完成反应化学方程式的书写;(4)根据镁与氢氧化钠溶液不反应,最后剩余固体的质量就是镁的质量,根据第一次消耗铝的质量,计算出消耗的氢氧化钠的质量,再除以20g即可.
点评:解答本题关键是要知道反应类型的判断方法,方程式的书写注意事项,知道根据方程式的简单计算技巧.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.