题目内容
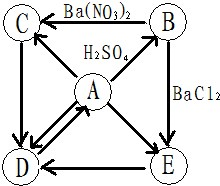 已知A是一种黑色单质,B、C、E是初中常见的盐,D是一种红色物质.下图是这物质的转化关系,部分反应物、生成物及反应条件已省略.
已知A是一种黑色单质,B、C、E是初中常见的盐,D是一种红色物质.下图是这物质的转化关系,部分反应物、生成物及反应条件已省略.(1)请写出下列物质的化学式:A
(2)A→B反应的实验现象为
(3)A→E反应的化学方程式为
(4)B→C反应的化学方程式为
考点:物质的鉴别、推断,化学式的书写及意义,反应类型的判定,书写化学方程式、文字表达式、电离方程式
专题:框图型推断题
分析:根据A是一种黑色单质,A和硫酸会发生反应,B、C、E是初中常见的盐,D是一种红色物质,A和D可以相互转化,所以A是铁,D是氧化铁,铁和硫酸反应生成硫酸亚铁和氢气,B和硝酸钡、氯化钡会反应,所以B是硫酸亚铁,硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁,硫酸亚铁和氯化钡反应生成硫酸钡沉淀和氯化亚铁,铁会转化成C、E,所以C是硝酸亚铁,E是硫酸亚铁,然后将推出的各种物质代入转化关系中验证即可.
解答:解:(1)A是一种黑色单质,A和硫酸会发生反应,B、C、E是初中常见的盐,D是一种红色物质,A和D可以相互转化,所以A是铁,D是氧化铁,铁和硫酸反应生成硫酸亚铁和氢气,B和硝酸钡、氯化钡会反应,所以B是硫酸亚铁,硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁,硫酸亚铁和氯化钡反应生成硫酸钡沉淀和氯化亚铁,铁会转化成C、E,所以C是硝酸亚铁,E是硫酸亚铁,经过验证,推出的各种物质均满足题中的转化关系,推导合理,所以A是Fe,E是FeCl2;
(2)A→B的反应铁和硫酸反应生成硫酸亚铁和氢气,实验现象为:固体逐渐溶解,溶液由无色变成浅绿色,有无色气体生成,铁和硫酸反应生成硫酸亚铁和氢气的反应是置换反应,硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁的反应是复分解反应,硝酸亚铁和氢氧化钠生成氢氧化亚铁和硝酸钠的反应是复分解反应,氢氧化亚铁和水氧气生成氢氧化铁的反应生成化合反应,氢氧化铁分解生成氧化铁和水的反应是分解反应,所以上图所示物质的转化关系中一共包括4种基本反应类型.分别为置换反应、复分解反应、化合反应、分解反应;
(3)A→E的反应是盐酸和铁反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(4)B→C的反应是硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁,化学方程式为:FeSO4+Ba(NO3)2=BaSO4↓+Fe(NO3)2.
故答案为:(1)Fe,FeCl2;
(2)固体逐渐溶解,溶液由无色变成浅绿色,有无色气体生成,4,置换反应、复分解反应、化合反应、分解反应;
(3)Fe+2HCl=FeCl2+H2↑;
(4)FeSO4+Ba(NO3)2=BaSO4↓+Fe(NO3)2.
(2)A→B的反应铁和硫酸反应生成硫酸亚铁和氢气,实验现象为:固体逐渐溶解,溶液由无色变成浅绿色,有无色气体生成,铁和硫酸反应生成硫酸亚铁和氢气的反应是置换反应,硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁的反应是复分解反应,硝酸亚铁和氢氧化钠生成氢氧化亚铁和硝酸钠的反应是复分解反应,氢氧化亚铁和水氧气生成氢氧化铁的反应生成化合反应,氢氧化铁分解生成氧化铁和水的反应是分解反应,所以上图所示物质的转化关系中一共包括4种基本反应类型.分别为置换反应、复分解反应、化合反应、分解反应;
(3)A→E的反应是盐酸和铁反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(4)B→C的反应是硫酸亚铁和硝酸钡反应生成硫酸钡沉淀和硝酸亚铁,化学方程式为:FeSO4+Ba(NO3)2=BaSO4↓+Fe(NO3)2.
故答案为:(1)Fe,FeCl2;
(2)固体逐渐溶解,溶液由无色变成浅绿色,有无色气体生成,4,置换反应、复分解反应、化合反应、分解反应;
(3)Fe+2HCl=FeCl2+H2↑;
(4)FeSO4+Ba(NO3)2=BaSO4↓+Fe(NO3)2.
点评:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.

练习册系列答案
相关题目
善于归纳和总结是科学的学习方法,下列归纳正确的是( )
| A、O2、CO2、NaCl都是由分子直接构成的物质 |
| B、合金、合成纤维、合成橡胶都属于合成材料 |
| C、碳酸氢铵、硫酸铵、尿素都是常用氮肥 |
| D、葡萄糖、乙醇、碳酸钾都属于有机化合物 |
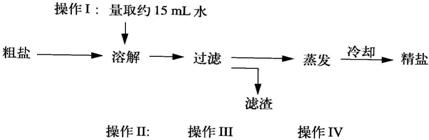
 A、B、C、D、E分别是二氧化碳、稀盐酸、一氧化碳、氧化铜和碳酸钙中的一种物质.通常情况下C为液体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应.用“→”表示一种物质能转化为另一种物质.请回答下列问题:
A、B、C、D、E分别是二氧化碳、稀盐酸、一氧化碳、氧化铜和碳酸钙中的一种物质.通常情况下C为液体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应.用“→”表示一种物质能转化为另一种物质.请回答下列问题: 在“空气中氧气含量的测定”实验探究中,小明设计了如图所示实验装置,集气瓶下端为开口(即没有瓶底),上端瓶口有一带有燃烧匙的橡皮塞,瓶上带有刻度线,把集气瓶离水面的位置与橡皮塞之间的容积分成五等份.实验时把点燃的红磷立即插入集气瓶内,塞紧橡皮塞.回答下列问题:
在“空气中氧气含量的测定”实验探究中,小明设计了如图所示实验装置,集气瓶下端为开口(即没有瓶底),上端瓶口有一带有燃烧匙的橡皮塞,瓶上带有刻度线,把集气瓶离水面的位置与橡皮塞之间的容积分成五等份.实验时把点燃的红磷立即插入集气瓶内,塞紧橡皮塞.回答下列问题: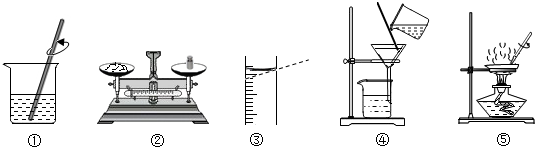

 如图是甲、乙、丙三种固体的溶解度曲线,回答下列问题:
如图是甲、乙、丙三种固体的溶解度曲线,回答下列问题: