题目内容
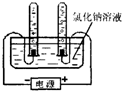
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因______.
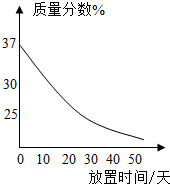
(2)观察图,向小试管内滴加水后,可观察到的现象是______.解释产生此现象的原因______.
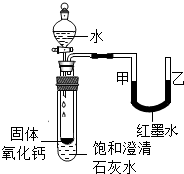
(3)如分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显______(填“酸性”?“中性”或“碱性”下同),乙醇的水溶液显______.
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
①写出稀盐酸和氢氧化钠溶液反应的化学方程式______.
②若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显______色.
③若滴加的指示剂是无色酚酞溶液,加入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)______.

(2)观察图,向小试管内滴加水后,可观察到的现象是______.解释产生此现象的原因______.

(3)如分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显______(填“酸性”?“中性”或“碱性”下同),乙醇的水溶液显______.

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
②若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显______色.
③若滴加的指示剂是无色酚酞溶液,加入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)______.
(1)浓盐酸具有挥发性,挥发出氯化氢气体,敞口放置时溶质质量减少,溶剂质量不变,所以溶质的质量分数减小.
故答案为:浓盐酸具有挥发性,挥发出氯化氢气体.
(2)氧化钙与水反应放热、氢氧化钙的溶解度随温度的升高而降低,有氢氧化钙从溶液中析出;氧化钙与水反应放热使试管内压强增大,会使U形管中甲液面下降乙液面升高.
故答案为:石灰水变浑浊;U型管中甲端下降乙端上升.
(3)由图可知,溴化氢溶液中含有氢离子,所以溶液显酸性,而乙醇溶液中溶液既无氢离子,也无氢氧根离子,所以溶液显中性.
故答案为:酸性、中性.
(4)由图标可知,当加入氢氧化钠溶液10mL时,溶液pH=7,氢氧化钠溶液与稀盐酸恰好完全反应,所以当加入13mL氢氧化钠溶液时,溶液显碱性,滴入紫色石蕊溶液会显蓝色;若滴加无色酚酞溶液,加入氢氧化钠溶液充分振荡后,溶液颜色无变化,只能说明溶液不显碱性,可能是酸被反应完,也可能是有酸剩余,所以此时溶液中的溶质一定有生成的氯化钠.
故答案为:①HCl+NaOH═NaCl+H2O;②蓝;③NaCl
故答案为:浓盐酸具有挥发性,挥发出氯化氢气体.
(2)氧化钙与水反应放热、氢氧化钙的溶解度随温度的升高而降低,有氢氧化钙从溶液中析出;氧化钙与水反应放热使试管内压强增大,会使U形管中甲液面下降乙液面升高.
故答案为:石灰水变浑浊;U型管中甲端下降乙端上升.
(3)由图可知,溴化氢溶液中含有氢离子,所以溶液显酸性,而乙醇溶液中溶液既无氢离子,也无氢氧根离子,所以溶液显中性.
故答案为:酸性、中性.
(4)由图标可知,当加入氢氧化钠溶液10mL时,溶液pH=7,氢氧化钠溶液与稀盐酸恰好完全反应,所以当加入13mL氢氧化钠溶液时,溶液显碱性,滴入紫色石蕊溶液会显蓝色;若滴加无色酚酞溶液,加入氢氧化钠溶液充分振荡后,溶液颜色无变化,只能说明溶液不显碱性,可能是酸被反应完,也可能是有酸剩余,所以此时溶液中的溶质一定有生成的氯化钠.
故答案为:①HCl+NaOH═NaCl+H2O;②蓝;③NaCl

练习册系列答案
相关题目