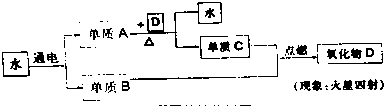
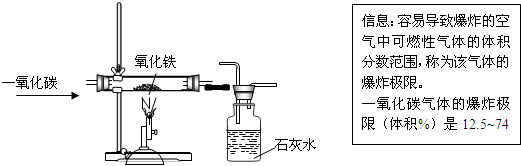
题目内容
根据化学方程式判断属于化合反应的是
A、2HgO 2Hg
+ O2↑
B、3CO+Fe2O3
2Hg
+ O2↑
B、3CO+Fe2O3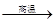 2Fe+3CO2
2Fe+3CO2
C、C+CO2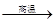 2CO
D、CH4+2O2
2CO
D、CH4+2O2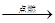 CO2+2H2O
CO2+2H2O
【答案】
C
【解析】
试题分析:化合反应是由两种或两种以上的物质生成另一种物质的反应,由此排除ABD选项,答案选择C
考点:化合反应

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶夜,但确实发生了化学反应.请你与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH 溶夜混合前后的pH(20℃).测定某NaOH 溶夜的pH,pH______7(选填“大于”“等于”或“小于”).将一定量的稀H2SO4 加入该NaOH 溶夜中,混合均匀后测定其pH,pH小于7.
结论:稀H2SO4 与NaOH 溶液发生了化学反应,并且______过量.该反应化学方程式为______
(2)为了进一步获取稀H2SO4 与NaOH 溶液确实发生了化学反应的证据,依据中和反应是放热反应,H2SO4 与NaOH反应是______(选填“放热”“吸热”或“无热量变化”)的反应,采用稀H2SO4 与NaOH 溶液进行实验验证,具体操作是______.
(3)方案二:利用酸碱指示剂.回忆课堂上你和老师共同完成的酸、碱反应的实验探究,并依照下列要求进行实验的设计与分析:
①请你依据如图所示设计一个酸和碱反应的探究实验.

表1 探究实验
| 实验步骤 | 实验现象 | 结论 |
| a.向烧杯中加入10ml 氢氧化钠溶液,并滴入几滴酚酞溶液; b.再用滴管慢慢滴入稀硫酸,并不断搅拌 | a.溶液颜色______; b.不断搅拌溶液至溶液 颜色恰好变成______为止. | 酸和碱发生了中和反应, 该反应属四种基本反应 类型中的______反应. |
表2 探究实验
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |