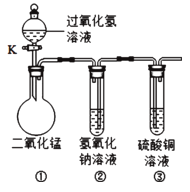
题目内容
【题目】碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
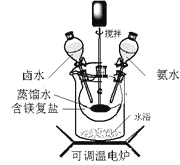
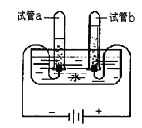
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
回答下列问题:
(1)①搅拌的目的是 ;②选择水浴加热方式,其优点是 。
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有 (填化学式)。
(3)设计实验检验碱式碳酸镁中含有Cl-
实验操作 | 实验现象 | 实验结论 |
①取样溶解,向样品溶液中滴加过量稀硝酸。 | 现象① ; | 含有 Cl- |
【探究二】定量测定碱式碳酸镁的组成
300℃ |
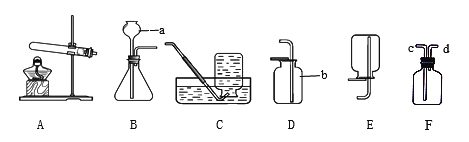
已知:碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O ="==" (x+y)MgO + xCO2↑+ (y+z) H2O探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。
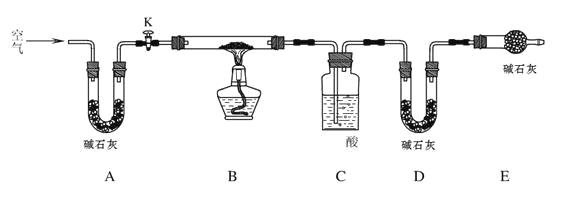
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g
B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g
D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中, ,对装置B用酒精灯微热,观察,若 ,则气密性良好;
(2)如果没有装置A,则测定得到的Z值 (填“偏大”、“偏小”、“无影响”),
装置C中的酸为 (写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)
中x∶y∶z= (要求写出过程,4分)。
【交流反思】
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x∶y∶z的值,还可测量的实验数据是 。
【答案】【探究一】
(1)①使反应物充分混合接触,提高反应速率 ②反应物均匀受热
(2)NH4Cl
(3)步骤②硝酸银或AgNO3现象①产生气泡 现象②白色沉淀
【探究二】
步骤4:打开活塞K,再次鼓入空气
(1)打开活塞K开关 若两端导管口处均出现气泡
(2)偏大 浓硫酸(浓字没有不得分)
(3)4∶1∶4
(4)样品的质量
【解析】试题分析:(1)①搅拌的目的是使反应物充分混合接触,提高反应速率,②此反应采用水浴加热的优点是反应物均匀受热;(2)因为混有氯化铵所以常检查出有氯离子;(3)先加入硝酸除去碳酸根离子的干扰,再加入硝酸银,有白色沉淀生成说明确实有氯离子存在。【探究二】步骤4:打开活塞K,再次鼓入空气,(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,打开活塞K开关对装置B用酒精灯微热,观察,若若两端导管口处均出现气泡则气密性良好;(2)如果没有装置A,空气中的二氧化碳会干扰实验,是C、D的质量增大,C装置中盛放的是浓硫酸。
(3)xMgCO3·yMg(OH)2·zH2O ="(x+y)MgO" + xCO2↑+ (y+z) H2O
40 (x+y) 44x 18(y+z)
20 g 17.6 g 9.0 g
![]() 得x=4y
得x=4y
![]() 得x=z
得x=z
由于x、y、z都为正整数,得x=" 4" y="1" z=4
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x∶y∶z的值,还可测量的实验数据是样品的质量。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】
[查阅资料]有些水果、蔬菜对过氧化氢的分解有催化作用。
[实验探究1]探究苹果和土豆对过氧化氢分解是否有催化作用及催化效果:
各量取6ml的过氧化氢溶液,分别倒入1、2、3号三志试管中,取大小、形状基本相同的苹果块和土豆块,分别放入2、3号试管中,并把带火星的木条分别同时伸入三支试管口内,观察现象并记录如下:
试管编号 | 1 | 2 | 3 | |
材料名称 | 无 | 苹果 | 土豆 | |
实验现象 | 反应速率 | 很慢 | 稍快 | 较快 |
产生气泡 | 很少 | 比1中多 | 较多 | |
复燃情况 | 不复燃 | 复燃 | 很快复燃 | |
实验结论 | ||||
[实验探究2]探究浓度对过氧化氢分解速率的影响:
取10ml30%的过氧化氢三份,将其中两份分别稀释为不同浓度的溶液,同时测定收集到100ml氧气所用的时间,(其它实验条件均相同)记录如下:
实验编号 | 1 | 2 | 3 |
过氧化氢溶液浓度 | 5% | 15% | 30% |
所用时间(秒) | 205 | 25 | 3 |
实验结论 | |||
[实验条件3]用上述收集的仪器与不同位置进行反应,其中有一固体能在氧气中燃烧,发出明亮的蓝紫色火焰,生成刺激性气味的气体,该反应的化学方程式为: 。