��Ŀ����
����Ŀ����5�֣���֪A��B��C��D��E��F��G��H��I��Ϊ���л�ѧ���������ʡ�����E��GΪ����������E��Ŀǰ�����ϲ�����ߵĽ�����G���Ϻ�ɫ��I�ǵؿ��к�����ߵ�Ԫ�����γɵij������嵥�ʣ�����θҺ�к���A���ɰ���������������ͼ��ʾ��ת����ϵ���ش��������⡣��ͼ�з�Ӧ����������ȥ����Ӧ��Ͳ�����Ѹ�����
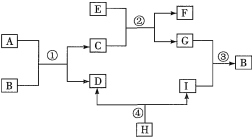
��1��E�������� ��H�Ļ�ѧʽ�� ��
��2��д����Ӧ�����ڵĻ�ѧ����ʽ���� ���� ��
��3����ͼ���漰�� ������Ӧ���͡�
A��һ�� B������ C������ D������
���𰸡���1������H2O2 ��2���� CuO+2HCl=CuCl2+ H2O ���� Fe+CuCl2==Cu+FeCl2 ��3�� D
��������
�������������ͼ��ʾ��ת����ϵ֪��AΪ���ᡢBΪ����ͭ��CΪ�Ȼ�ͭ��DˮΪ��EΪ����FΪ�Ȼ�������GΪͭ��H��������Ϊ��IΪ�������ʣ�1��E������������H�Ļ�ѧʽΪH2O2 ��2������Ӧ�Ļ�ѧ����ʽ��CuO+2HCl=CuCl2+ H2O���ڷ�Ӧ�Ļ�ѧ����ʽFe+CuCl2==Cu+FeCl2 ��3����ͼ���漰�����ֻ�����Ӧ���͡���

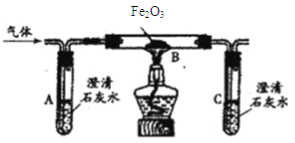
����Ŀ����5�֣�ij��ѧС����ʵ������CO��Fe2O3���ܱ������и���������ǿ��ģ���������̣�һ��ʱ����ռ����������ݣ�
���� | CO | Fe2O3 | Fe | M | CO2 |
��Ӧǰ������g�� | 2.8 | 16 | 0 | 0 | 0 |
��Ӧ��������g�� | 0 | 0 | 0 | a | b |
��1��Ԥ�ڿ�����ʵ������Ӧ���� ��
��2��ʵ������п�����ʵ��������Ԥ�ڵ�������������������Ͽ�֪��CO��ԭFe2O3ʱ��һ�������¿�������������������FeO��Fe3O4������Ҳ��Ϊ��ɫ���壬�����Ļ�ѧ��Ӧ����ʽ�ֱ�ΪFe2O3+CO![]() 2FeO+CO2�� .
2FeO+CO2�� .
��2������b��ֵΪ ������M�Ļ�ѧʽΪ ��