题目内容
【题目】A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,乙是无色液体,它们之间有如下的转化关系(部分产物和反应条件未标明)。
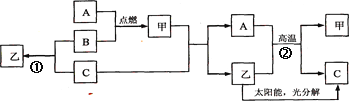
(1)推断C的化学式为:C ______________;
(2)A在B中点燃的实验现象是___________________________;
(3)写出反应①的化学方程式___________________________;
(4)写出反应②的化学方程式_________________________。
【答案】 H2 剧烈反应,火星四射,放出大量热,生成黑色固体 2H2+O2![]() 2H2O 3Fe+4H2O
2H2O 3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
【解析】A是常见金属单质,A是铁,B、C是非金属单质,且C是密度最小的气体,C为氢气,甲是磁铁矿的主要成分,甲是四氧化三铁,B是氧气,乙是无色液体——水,氢气和氧气点燃条件下生成水;氧气和铁点燃条件下生成四氧化三铁;四氧化三铁和氢气在加热条件下反应生成铁和水;铁和水在高温条件下生成四氧化三铁和氢气;水在太阳能和光分解催化剂的作用下分解生成氧气和氢气。 故: (1) C的化学式为:H2;(2)铁在氧气中点燃的实验现象是剧烈反应,火星四射,放出大量热,生成黑色固体;(3)反应①的化学方程式2H2+O2 ![]() 2H2O;(4)反应②的化学方程式3Fe+4H2O
2H2O;(4)反应②的化学方程式3Fe+4H2O ![]() Fe3O4+4H2。
Fe3O4+4H2。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】钢铁工业是国家工业的基础。目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
⑴铁的广泛应用
a.我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理________。
b.某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为___________________________。
⑵工业上若采用的铁矿石的主要成分为氧化铁,则炼铁的主要反应原理为_______________(用化学方程式表示),其所用的设备为_________,生铁出口低于炉渣出口的原因是__________________。
⑶某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
【设计实验】 用一氧化碳还原纯净的氧化铁粉末,实验装置如图。
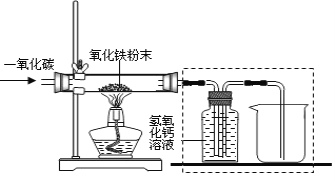
【进行实验】
该小组按上述实验设计进行实验,实验时应先__________(填“通入一氧化碳”或“点燃酒精灯”),目的是:___________________。
测得下列数据:
①反应前玻璃管和内盛纯净氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g);
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)。
【分析与讨论】 本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
物质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中可能含有____________和____________。
②进行猜想:黑色固体粉末可能 a.全部为铁 b.________ c.____________
【得出结论】 通过实验中获得的数据进行计算,得出黑色固体粉末为____________。
【反思与评价】
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高温度和反应时间。
②实验装置图中采用虚线框内的装置,其作用有_____________和______________等。
