题目内容
某活动小组在一次活动探究实验后,得知废液中含有硝酸银、硝酸铝产生了好奇心,想回收一种重要的金属和一种晶体,进行了下列实验,请回答下列问题:
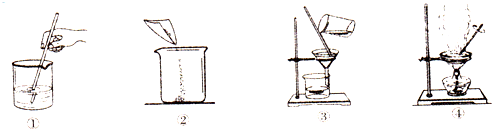
(1)操作的顺序是 ;
(2)②步加入的金属粉末是 ;
(3)发生反应的化学方程式为 ;
(4)操作④停止加热的时刻是 .

(1)操作的顺序是
(2)②步加入的金属粉末是
(3)发生反应的化学方程式为
(4)操作④停止加热的时刻是
考点:金属的化学性质,蒸发与蒸馏操作,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)根据组成混合物的各物质的性质分析的分离方法,再排序;
(2)根据在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,由于硫酸铜属于重金属盐,对人体有害,所以应该选择适当的金属将硫酸铜中的铜置换出来.
(3)根据反应物、生成物和条件书写方程式.
(4)根据蒸发的注意事项分析回答.
(2)根据在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,由于硫酸铜属于重金属盐,对人体有害,所以应该选择适当的金属将硫酸铜中的铜置换出来.
(3)根据反应物、生成物和条件书写方程式.
(4)根据蒸发的注意事项分析回答.
解答:解:(1)由于实验目的“想回收一种重要的金属和一种晶体”所以加入的金属后溶液中只有一种溶质,所以加入的金属是铝粉;分离的过程是:先将样品溶解,后加入铝粉,充分反应后进行过滤,对滤渣进行洗涤、干燥回收金属,对滤液进行蒸发、干燥的回收硝酸铝晶体.所以顺序为:②①③④;
(2)由上述分析可知加入的金属粉末是铝;
(3)铝与硝酸银反应生成硝酸铝和银,方程式为:Al+3AgNO3=Al(NO3)3+3Ag;
(4)操作④是蒸发,停止加热的时刻是:出现较多量的固体时.
故答为:(1)②①③④;(2)铝;(3)Al+3AgNO3=Al(NO3)3+3Ag;(4)出现较多量的固体时.
(2)由上述分析可知加入的金属粉末是铝;
(3)铝与硝酸银反应生成硝酸铝和银,方程式为:Al+3AgNO3=Al(NO3)3+3Ag;
(4)操作④是蒸发,停止加热的时刻是:出现较多量的固体时.
故答为:(1)②①③④;(2)铝;(3)Al+3AgNO3=Al(NO3)3+3Ag;(4)出现较多量的固体时.
点评:本题考查了物质的分离及金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目


 如图是厨房一角,请根据图中所标物品回答下列问题:
如图是厨房一角,请根据图中所标物品回答下列问题: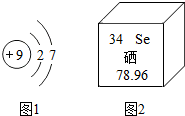 人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.
人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.