题目内容
(2011?南沙区一模)海洋是地球上最大的储水库,浩瀚的海洋蕴藏着丰富的化学资源,从海水中可以提取出大量的镁.其主要步骤如下: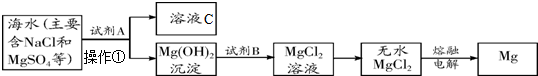
(1)提取Mg的过程中,试剂A可以选用
(2)操作①的名称是
(3)分离出Mg(OH)2后的溶液C中含有较多的氯化钠,也还含有CaCl2、Na2SO4等杂质.工业上为了获得较纯净NaCl溶液,在分离后的溶液中先加入过量的BaCl2溶液,可以除去

(1)提取Mg的过程中,试剂A可以选用
氢氧化钠
氢氧化钠
,试剂B选用盐酸
盐酸
.写出加入试剂A之后的化学方程式MgSO4+2NaOH═Mg(OH)2↓+Na2SO4
MgSO4+2NaOH═Mg(OH)2↓+Na2SO4
.(2)操作①的名称是
过滤
过滤
.(3)分离出Mg(OH)2后的溶液C中含有较多的氯化钠,也还含有CaCl2、Na2SO4等杂质.工业上为了获得较纯净NaCl溶液,在分离后的溶液中先加入过量的BaCl2溶液,可以除去
Na2SO4
Na2SO4
;再加入过量的Na2CO3溶液的目的是除去CaCl2和过量的BaCl2
除去CaCl2和过量的BaCl2
.写出加入碳酸钠后的反应的化学方程式①Na 2CO3+CaCl2 ═CaCO3↓+2NaCl
Na 2CO3+CaCl2 ═CaCO3↓+2NaCl
;②Na 2CO3+BaCl2 ═BaCO3↓+2NaCl
Na 2CO3+BaCl2 ═BaCO3↓+2NaCl
.最后再加入过量的盐酸,并蒸发结晶.蒸发结晶的过程中用到了与操作①相同的玻璃仪器是玻璃棒
玻璃棒
.分析:根据物质的性质以及已有的知识进行分析,要提取镁,需要将海水中的硫酸镁逐步转化生成氯化镁,所加入的试剂在除去其他杂质的同时不能引入新的杂质.
解答:解:(1)要提取镁,可以首先使海水中的硫酸镁与碱反应生成氢氧化镁沉淀,要使氢氧化镁转化成氯化镁,可以加入盐酸,硫酸镁能与氢氧化钠反应生成硫酸钠和氢氧化镁沉淀,故填:NaOH,HCl,MgSO4+2NaOH═Mg(OH)2↓+Na2SO4;
(2)要将生成的氢氧化镁沉淀与溶液分离,可以使用过滤的方法,故填:过滤;
(3)要除去氯化钠中的CaCl2、Na2SO4等杂质,可以首先加入氯化钡溶液除去硫酸钠,加入的碳酸钠溶液能与氯化钙溶液反应生成碳酸钙沉淀,能与上一步中多加的氯化钡反应生成碳酸钡沉淀,蒸发结晶和过滤操作都需要用到玻璃棒,故填:Na2SO4,除去CaCl2和过量的BaCl2,Na 2CO3+CaCl2 ═CaCO3↓+2NaCl,Na 2CO3+BaCl2 ═BaCO3↓+2NaCl,玻璃棒.
(2)要将生成的氢氧化镁沉淀与溶液分离,可以使用过滤的方法,故填:过滤;
(3)要除去氯化钠中的CaCl2、Na2SO4等杂质,可以首先加入氯化钡溶液除去硫酸钠,加入的碳酸钠溶液能与氯化钙溶液反应生成碳酸钙沉淀,能与上一步中多加的氯化钡反应生成碳酸钡沉淀,蒸发结晶和过滤操作都需要用到玻璃棒,故填:Na2SO4,除去CaCl2和过量的BaCl2,Na 2CO3+CaCl2 ═CaCO3↓+2NaCl,Na 2CO3+BaCl2 ═BaCO3↓+2NaCl,玻璃棒.
点评:本题考查了物质提纯的知识,完成此题,可以依据物质的性质进行.选择的除杂试剂与杂质反应时不能引入新的杂质.

练习册系列答案
相关题目