题目内容
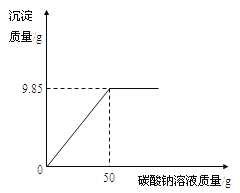
【题目】小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量分数。取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,得到了如图所示的曲线关系。
技术员给小红的提示:
①反应的化学方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl
②水的密度:1g/cm3,求产品中氯化钠的质量分数。
【答案】解:设样品中BaCl2的质量为x
Na2CO3 + BaCl2=BaCO3↓+2NaCl
106 208
50g×10.6% x
(2分)
![]() x=10.4g
x=10.4g
(2分)
产品中NaCl的质量分数为![]() ×100%=36% (2分)
×100%=36% (2分)
答:产品中NaCl的质量分数为36%。
【解析】
试题分析:已知沉淀质量=9.85g=m(BaCO3),50g溶质质量分数为10.6%的碳酸钠溶液参与反应,即m(Na2CO3)= 50g×10.6%=5.3g;反应方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl;要求产品中氯化钠的质量分数,氯化钠的质量分数=反应前的NaCl的质量/固体样品质量×100%,即要求反应前NaCl的质量,可以通过沉淀质量或者碳酸钠质量结合方程式求出BaCl2的质量,再得到NaCl的质量。

练习册系列答案
相关题目