题目内容
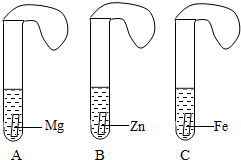
 19、一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤:
19、一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤:①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
实验现象分析:
(1)比较后发现气球膨胀速度最快的是A试管,表明Mg、Zn、Fe三种金属中Mg最活泼,写出Mg与盐酸反应的化学方程式:
Mg+2HCl=MgCl2+H2↑
.(2)实验室一般选用Zn而不选用Mg、Fe制取氢气的主要原因是:
锌反应速度适中,容易控制
.(3)为使探究达到预想目标,实验过程中需要注意的关键操作是:
为准确测量气球膨胀速度,需分工协作,进行观察测量记录,同步操作
.分析:金属与反反应的剧烈程度反应了金属的活动性强弱,实验中可以通过气球膨胀的速度来比较;为便于比较实验过程中要通过相关的变量.
解答:解:(1)镁能与盐酸剧烈反应产生大量的气泡同时放出大量的热.其化学方程式为:Mg+2HCl=MgCl2+H2↑
故答案为:Mg+2HCl=MgCl2+H2↑
(2)Mg、Zn、Fe三种金属的活动性强弱顺序是Mg>Zn>Fe,其中锌与酸反应的速度比较适中,故一般选锌与来制取氢气.
故答案为:锌反应速度适中,容易控制(或镁反应速度太快,而铁反应速度太慢)
(3)若要通过气球膨胀的速度来判断金属的活动性强弱,需要三个实验同时进行以便于比较.
故答案为:为准确测量气球膨胀速度,需分工协作,进行观察测量记录,同步操作.
故答案为:Mg+2HCl=MgCl2+H2↑
(2)Mg、Zn、Fe三种金属的活动性强弱顺序是Mg>Zn>Fe,其中锌与酸反应的速度比较适中,故一般选锌与来制取氢气.
故答案为:锌反应速度适中,容易控制(或镁反应速度太快,而铁反应速度太慢)
(3)若要通过气球膨胀的速度来判断金属的活动性强弱,需要三个实验同时进行以便于比较.
故答案为:为准确测量气球膨胀速度,需分工协作,进行观察测量记录,同步操作.
点评:一般可以通过金属被氧化的速度、与酸反应的剧烈程度、是否与相应的盐溶液反应三个方面来判断金属的活动性强弱.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目