题目内容
【题目】配置溶液、计算练习
(1)实验室需配制100克质量分数为5%的食盐溶液,该实验中需要准确量取水______毫升。若某学生用量筒取水时,面对刻度线仰视凹液面最低处,则其所配制溶液中NaCl的质量分数_______5%(填“>”、“<”或“=”)。
(2)要配制800Kg质量分数为0.5%的过氧乙酸消毒液,需要质量分数为16%的过氧乙酸溶液的质量是_____________。(写出解题过程)
(3)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
实验次数 项目 | 第一次 | 第二次 | 第三次 |
所取合金的质量/g | 20 | 20 | 40 |
所加稀硫酸的质量/g | 100 | 120 | 80 |
生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
根据该同学的实验,试回答以下问题:
①上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_______g。
②该铜铁合金中铁的质量分数是_________(写出解题过程)
③第三次实验所得溶液溶质质量分数为________?((写出解题过程,结果保留至0.1%)。
【答案】95 < 2.5kg 80 56% 33.5%
【解析】
溶液稀释前后溶质质量不变,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,第一次和第二次两个实验所加合金质量相同,而所加稀硫酸的质量不同,但最后产生氢气的质量相同,说明第一次和第二次两个实验中合金均反应完,第二次实验中的酸一定过量;第三次实验与前两次实验相比,合金质量加倍,而稀硫酸的质量减少,但产生氢气质量不变,20g合金反应完需要消耗稀硫酸80g。
(1)配制100克质量分数为5%的食盐溶液,需要食盐的质量为![]() ,该实验中需要准确量取水的质量为
,该实验中需要准确量取水的质量为![]() ,需要准确量取水的体积
,需要准确量取水的体积![]() 。若某学生用量筒取水时,面对刻度线仰视凹液面最低处,读数偏小,实际量取的水的体积偏大,溶液质量偏大,溶质质量分数偏小,故所配制溶液中NaCl的质量分数<5%。
。若某学生用量筒取水时,面对刻度线仰视凹液面最低处,读数偏小,实际量取的水的体积偏大,溶液质量偏大,溶质质量分数偏小,故所配制溶液中NaCl的质量分数<5%。
(2)设需要质量分数为16%的过氧乙酸溶液的质量是x
![]()
![]()
故需要质量分数为16%的过氧乙酸溶液的质量是2.5kg。
(3)①第一次和第二次两个实验所加合金质量相同,而所加稀硫酸的质量不同,但最后产生氢气的质量相同,说明第一次和第二次两个实验中合金均反应完,第二次实验中的酸一定过量;第三次实验与前两次实验相比,合金质量加倍,而稀硫酸的质量减少,但产生氢气质量不变,20g合金反应完需要消耗稀硫酸80g,故合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是80g。
②设铜铁合金中铁的质量分数为x
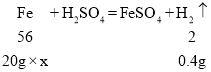
![]()
![]()
故铜铁合金中铁的质量分数是56%。
③设生成硫酸亚铁的质量为y
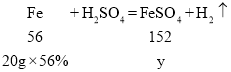
![]()
![]()
所得硫酸亚铁溶液的质量为![]()
故第三次实验所得溶液溶质质量分数为![]()

【题目】预防新冠病毒传染,从我做起。
(1)疫情期间,人们可通过摄入蛋白质和维生素来增强体质。下列菜谱中同时含这两种营养素的是_____
A 小白菜豆腐汤 B 水煮鸡蛋 C 白面馒头 D 青椒肉丝
(2)戴口罩可预防飞沫传染。如图N95口罩所用材料中,属于合成材料的是_____。(填数字序号)

名称 | 洁厕灵 | 84消毒液 |
产品样式 |
|
|
有效成分或功能 | 盐酸 | 次氯酸钠(NaClO) |
(3)如表为家中常见的清洁剂和消毒剂。正确的清洁和消毒,能有效的消灭病菌。
①清除以下物质,可使用洁厕灵的是_____(填字母序号)。
A 铁锈 B 油污 C 水垢 D 木炭还原氧化铜后,试管内壁残余的红色痕迹
②将洁厕灵与84消毒液混合使用,其有效成分会反应生成氯化钠、水和一种有毒的气体单质,请写出反应的方程式_____。
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)
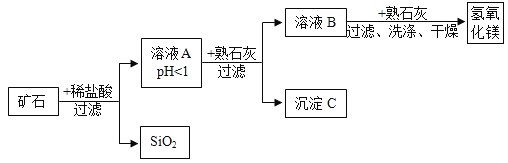
请回答下列问题:
(1)写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______(只写一个)。
(2)在过滤操作中,玻璃棒的作用是______。
(3)在溶液A中加入熟石灰调节溶液的pH可以使溶液中的金属阳离子逐步转化为沉淀。在该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为______
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出在溶液B中加入熟石灰发生的化学反应方程式:______。