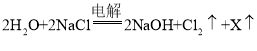题目内容
【题目】2019年诺贝尔化学奖授予在锂离子电池研发领域作出卓越贡献的三名科学家。
(1)图1是锂在元素周期表中的信息,图2为锂原子结构示意图。
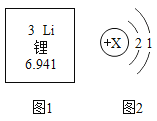
①图1中“6.941”表示_____。
②图2中X的数值为_____。
③化学反应中,锂原子容易_____(填“得”或“失”)电子,形成_____(写微粒符号)。
(2)某锂电池充电时发生反应的化学方程式如下(反应条件略去):2LiCoO2 + C6=2Li0.5CoO2 + LiC6。
①LiCoO2中Co的化合价为+3,则Li的化合价为_____。
②反应后,含Co物质中,Co的质量分数_____(填“变大”“变小”或“不变”)。
【答案】相对原子质量 3 失 Li+ +1 变大
【解析】
(1)①元素周期表汉字下面的数字表示相对原子质量,故填:相对原子质量;
②根据原子中质子数=核外电子数,X=2+1=3,故填:3;
③锂原子最外层上有1个电子,在发生化学反应时易失去1个电子形成带一个单位正电荷的锂离子,故填:失;Li+;
(2)①LiCoO2中Co的化合价为+3,氧元素显-2价,设锂元素的化合价是x,根据在化合物中正负化合价代数和为零,可得x+(+3) +(-2)×2=0,x=+1,故填:+1;
②反应前含Co物质化学式是LiCoO2,反应后含Co物质化学式是Li0.5CoO2,由两者化学式比较,Li的原子个数由1变为0.5,其他不变,![]() ,反应后含Co物质中,Co的质量分数变大,故填:变大。
,反应后含Co物质中,Co的质量分数变大,故填:变大。

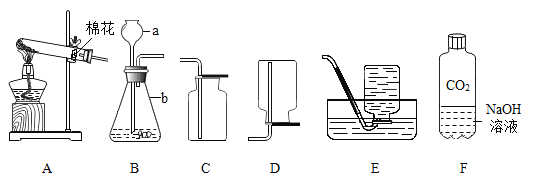
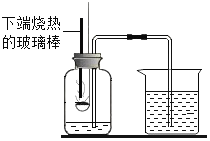
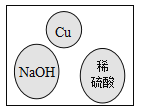
【题目】某化学兴趣小组在实验室做了如图所示的A、B两个实验。
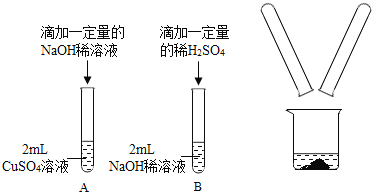
(1)B实验中发生反应的化学方程式为_____________________________________。
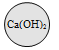
(2)A、B两个实验结束后,小组同学将两支试管中的废液同时倒入一洁净的烧杯中(如图所示),混合后,观察到烧杯中有蓝色沉淀.同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
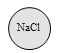
(猜想)小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是_____________________。
(讨论)你认为_________的猜想一定不合理,理由是_______________。如果滤液为无色,还可排除_____的猜想。
(实验)若你的猜想正确,请完成下表的方案。
实验步骤 | 预期的实验现象 | 实验结论 |
取少量滤液于试管中,滴入_____ | ___________________ | 你的猜想正确 |