题目内容
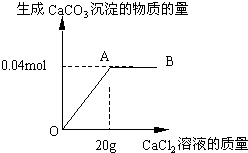 碳酸钠和氯化钠的混合物14g,常温下溶解在足量的水中,向溶液中逐滴加入氯化钙溶液.加入氯化钙溶液的质量与生成CaCO3沉淀的物质的量的关系如图.
碳酸钠和氯化钠的混合物14g,常温下溶解在足量的水中,向溶液中逐滴加入氯化钙溶液.加入氯化钙溶液的质量与生成CaCO3沉淀的物质的量的关系如图.(1)图象中表示恰好完全反应的点是
A
A
;(2)恰好完全反应时生成CaCO3沉淀的物质的量是
0.04
0.04
mol;参加反应的碳酸钠的物质的量是0.04
0.04
mol;(3)原混合物中:碳酸钠的质量是
4.24
4.24
g,氯化钠的质量分数是69.71%
69.71%
(精确到0.01%)分析:碳酸钠和氯化钠的混合物中的碳酸钠与所加入的氯化钙反应生成碳酸钙沉淀,随向溶液中逐滴加入氯化钙溶液质量增加,生成碳酸钙沉淀质量随之不断增加,至碳酸钠完全反应,生成沉淀的质量不再改变即曲线的A点,利用此时生成沉淀的质量,根据反应的化学方程式,计算出混合物中碳酸钠的质量即可求得原混合物中氯化钠的质量.
解答:解:(1)曲线A点表示生成碳酸钙的质量达最大值,即碳酸钠与所加氯化钙恰好完全反应;
(2)恰好完全反应时生成CaCO3沉淀的物质的量是0.04mol;由Na2CO3+CaCl2═CaCO3↓+2NaCl可知参加反应的碳酸钠的物质的量是0.04mol.
(3)设混合物中Na2CO3的质量为x,碳酸钙的质量0.04mol×100g/mol=4g
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 4g
=
x=4.24g
氯化钠的质量14g-4.24g=9.76g
氯化钠的质量分数=
×100%=69.71%
答:氯化钠的质量分数是69.71%.
故答案为:(1)A;(2)0.04;0.04;(3)4.24;69.71%.
(2)恰好完全反应时生成CaCO3沉淀的物质的量是0.04mol;由Na2CO3+CaCl2═CaCO3↓+2NaCl可知参加反应的碳酸钠的物质的量是0.04mol.
(3)设混合物中Na2CO3的质量为x,碳酸钙的质量0.04mol×100g/mol=4g
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 4g
| 106 |
| x |
| 100 |
| 4g |
x=4.24g
氯化钠的质量14g-4.24g=9.76g
氯化钠的质量分数=
| 9.76g |
| 14g |
答:氯化钠的质量分数是69.71%.
故答案为:(1)A;(2)0.04;0.04;(3)4.24;69.71%.
点评:分析表示反应的曲线时,曲线的折点为所表示的反应恰好完全反应,由此点可得到恰好完全反应时反应中相关物质的质量.

练习册系列答案
相关题目
 (2013?泰安)小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液.他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验.
(2013?泰安)小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液.他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验.