题目内容
某化学研究性学习小组的同学将43.75g石灰石(杂质SiO2不参加反应,也不溶于水)放入一定质量的某稀盐酸中,恰好完全反应,过滤(滤液损失不计),得到114g滤液,再向其中加入163.5g水,结果就得到了10%的溶液作为路面保湿剂.计算原稀盐酸中溶质的质量分数.
18.25%
解析试题分析:反应后溶液中溶质氯化钙的质量为(114g+163.5g)×10%=27.75g,设石灰石中碳酸钙的质量是x 反应的氯化氢质量是y 生成二氧化碳的质量是z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y 27.75g z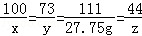
x=25g y=18.25g z=11g
则加入盐酸的质量为114g+11g﹣25g=100g,故所采用的盐酸溶质质量分数为: ×100%=18.25%
×100%=18.25%
答:盐酸中溶质的质量分数为18.25%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

化学小组在实验室用高锰酸钾制取氧气,加热一段时间后,剩余固体的质量为60g,小习同学继续加热该固体至不再有气体产生时,所得固体质量为56.8g,冷却后向56.8g固体中加足量水,过滤得到的滤渣为纯净物,质量为17.4g。剩余固体中钾元素的含量为…… ( )
| A.25% | B.52% | C.50% | D.26% |
A和B可发生反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量之和都是12g。有关实验数据见下表,x︰y的值可能为
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 10g | 2g | 6g |
| ② | 4g | 8g | 6g |
| ③ | xg | yg | 9g |
根据右图所提供的信息,下列对该袋食盐的判断不正确的是 
| A.该食盐中氯元素的质量分数最大 |
| B.每袋食盐中碘元素的质量为10 mg |
| C.每袋食盐中含碘酸钾的质量约为16.9 mg |
| D.若仅靠该盐补充碘,成人每天需摄入该食盐5 g |
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如表所示:
| | 甲 | 乙 | 丙 |
| 金属混合物质量/g | 10 | 10 | 20 |
| 稀硫酸质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲同学所得溶液中含有的溶质是 .
(2)计算丙同学所得溶液中溶质的质量分数.(计算结果精确到0.1%)
某碳酸钾溶液中,碳酸根与水分子数之比为1:100,向该溶液中通入足量二氧化碳,碳酸钾跟水和二氧化碳反应全部转变为碳酸氢钾,此碳酸氢钾溶液的溶质质量分数为
| A.5.26% | B.5.56% | C.7.13% | D.10.0% |