题目内容
【题目】糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
(1)【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为10,由此得出结论是碳酸氢钠溶液呈 .
(2)【探究实验二】碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸,现象为 . 结论:碳酸氢钠能与酸反应.
(3)【探究实验三】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所示.加热一段时间后,观察到烧杯内壁有水珠. 充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊.
通过进一步实验来确定充分加热后的固体产物的成分.限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量 | 产生白色沉淀 | 产物含Na2CO3 |
② | 取操作①后的上层清液于试管B中,滴加 | 产物不含NaOH |
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式 . 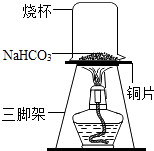
【答案】
(1)碱性
(2)产生大量气泡,固体逐渐溶解
(3)氯化钙;酚酞溶液;溶液不变色
(4)2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】解: 实验一:用pH试纸测得碳酸氢钠溶液的pH为10,大于7,显碱性;
实验二:碳酸氢钠能够和稀盐酸反应生成碳酸钠、水和二氧化碳气体;
实验三:(3)检验生成物是NaOH还是Na2CO3 , 加入足量的氯化钙溶液可以与碳酸钠溶液反应产生沉淀的物质,若有白色沉淀生成,说明固体产物是Na2CO3取反应后的上层清液,向其中滴加酚酞试液,酚酞试液不变红,说明溶液中不含氢氧根,说明固体产物中不含氢氧化钠;(4)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3 , 反应的化学方程式为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.
故答案为:碱性;产生大量气泡,固体逐渐溶解;氯化钙;酚酞溶液;溶液不变色;2NaHCO3 ![]() Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.
实验一:当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性.
实验二:根据碳酸氢钠的化学性质分析;
实验三:(3)检验生成物是NaOH还是Na2CO3 , 加入氯化钙溶液可以与碳酸钠反应产生沉淀的物质,据此进行分析解答.(4)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3 , 写出反应的化学方程式即可.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案