题目内容
长期露置在空气中的铜器表面有一层绿色固体.小强带着浓厚的兴趣对该绿色固体的元素组成进行研究.请你结合下列装置图回答问题.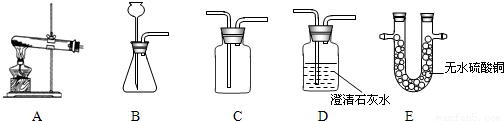
查阅资料:金属铜长时间放置在空气中,与氧气等物质发生复杂的化学反应,形成“铜绿”.
空气中氮气和稀有气体的化学性质稳定,常温下难与其他物质反应.
猜想与假设:经过思考和推理,小强认为“铜绿”的组成元素可能是铜、氧、氢、碳元素.
实验与结论:小强按实验设计连接A→______→______装置(填装置代号),在检查装置气密性后进行相关实验.请你帮助小强完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:将一定量绿色固体装入反应容器中,进行实验 | ①白色无水硫酸铜变蓝色 | 产物中有______ |
| ②______ | 产物中有二氧化碳 写出检验二氧化碳的化学方程式: ______ | |
| ③绿色固体变黑色 |
(1)小李根据碱式碳酸铜的化学式对黑色固体产物做出以下猜想:①可能是碳,②可能是氧化铜.③可能是碳和氧化铜的混合物.他做出以上猜想的依据是______;
(2)小王根据碳的化学性质,认为猜想③可以排除,理由是______;
(3)为验证①、②猜想,他们设计如下实验方案:向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,待完全反应后静置观察现象.若猜想①正确,现象应该是______;若猜想②正确,现象应该是______.
通过实验探究得知“铜绿”是由铜、氧、氢、碳四种元素组成.
反思与应用:大多数金属的锈蚀与铁、铜的锈蚀相似,金属的锈蚀给人类带来了巨大的损失,请写出防止金属锈蚀的一种方法:______.
【答案】分析:无水硫酸铜可用于检验是否有水,澄清石灰水可用于检验二氧化碳的存在;一般是先检验水分存在再检验其它气体.然后根据现象写出结论,或根据结论写出现象,完成实验报告;
(1)反应物为碱式碳酸铜[Cu2(OH)2CO3],根据质量守恒定律,化学反应前后元素的种类和质量都不变,所以反应后物质也由铜、氧、氢、碳几种元素组成,据此可作出猜想;
(2)猜想③碳和氧化铜的混合物受热会发生反应生成铜和二氧化碳,所以此猜想不合理;
(3)鉴别碳和氧化铜,根据其化学性质不同,可向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,碳和稀硫酸不反应,氧化铜和稀硫酸反应生成硫酸铜和水,溶液变蓝色,据此可鉴别碳和氧化铜.
(4)可从金属腐蚀的原理进行分析解答.
解答:解:无水硫酸铜可用于检验是否有水,澄清石灰水可用于检验二氧化碳的存在.所以我们可以用装置A连接装置E,看无水硫酸铜是否变蓝,如果变蓝,说明产物中有水生成;再通入装置D澄请石灰水,石灰水变浑浊说明有二氧化碳生成.故A可连接:ED;
二氧化碳与澄请石灰水反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O
故答案为:E;D,
(1)根据碱式碳酸铜的化学式对黑色固体产物做出猜想的依据是质量守恒定律,根据质量守恒定律,化学反应前后元素的种类不变;
(2)猜想③可以排除,理由是碳具有还原性,能将氧化铜还原为铜,二者在高温下不能共存;
(3)鉴别碳和氧化铜,向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,待完全反应后静置观察现象.若猜想①正确,因为碳和稀硫酸不反应,所以固体沉淀在试管底部,无现象;若猜想②正确,现象应该是氧化铜和稀硫酸反应生成硫酸铜和水,溶液变蓝色;
(4)金属在空气中被腐蚀主要是由于和空气中的氧气、水及二氧化碳反应所致,所以要防止金属被腐蚀通常采用将金属放在干燥的环境中或隔绝空气.如金属表面刷油漆、加镀层金属等.
故答案为:
(1)化学反应前后元素种类不变;
(2)C和CuO要发生反应;
(3)黑色固体不溶解,溶液不变色;黑色固体全部溶解,溶液由无色变成蓝色;
(4)刷油漆等;
点评:本题通过实验探究碱式碳酸铜的受热分解产物,属于中档题.实验猜想要有依据,不能凭空猜想,验证猜想要通过实验,依据碳和氧化铜的化学性质不同选择合适的试剂,根据实验现象不同可鉴别二者.
(1)反应物为碱式碳酸铜[Cu2(OH)2CO3],根据质量守恒定律,化学反应前后元素的种类和质量都不变,所以反应后物质也由铜、氧、氢、碳几种元素组成,据此可作出猜想;
(2)猜想③碳和氧化铜的混合物受热会发生反应生成铜和二氧化碳,所以此猜想不合理;
(3)鉴别碳和氧化铜,根据其化学性质不同,可向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,碳和稀硫酸不反应,氧化铜和稀硫酸反应生成硫酸铜和水,溶液变蓝色,据此可鉴别碳和氧化铜.
(4)可从金属腐蚀的原理进行分析解答.
解答:解:无水硫酸铜可用于检验是否有水,澄清石灰水可用于检验二氧化碳的存在.所以我们可以用装置A连接装置E,看无水硫酸铜是否变蓝,如果变蓝,说明产物中有水生成;再通入装置D澄请石灰水,石灰水变浑浊说明有二氧化碳生成.故A可连接:ED;
二氧化碳与澄请石灰水反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O
故答案为:E;D,
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:将一定量绿色固体装入反应容器中,进行实验 | ①白色无水硫酸铜变蓝色 | 产物中有 H2O |
| ②澄清石灰水变浑浊 | 产物中有二氧化碳 写出检验二氧化碳的化学方程式: CO2+Ca(OH)2═CaCO3↓+H2O | |
| ③绿色固体变黑色 |
(2)猜想③可以排除,理由是碳具有还原性,能将氧化铜还原为铜,二者在高温下不能共存;
(3)鉴别碳和氧化铜,向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,待完全反应后静置观察现象.若猜想①正确,因为碳和稀硫酸不反应,所以固体沉淀在试管底部,无现象;若猜想②正确,现象应该是氧化铜和稀硫酸反应生成硫酸铜和水,溶液变蓝色;
(4)金属在空气中被腐蚀主要是由于和空气中的氧气、水及二氧化碳反应所致,所以要防止金属被腐蚀通常采用将金属放在干燥的环境中或隔绝空气.如金属表面刷油漆、加镀层金属等.
故答案为:
(1)化学反应前后元素种类不变;
(2)C和CuO要发生反应;
(3)黑色固体不溶解,溶液不变色;黑色固体全部溶解,溶液由无色变成蓝色;
(4)刷油漆等;
点评:本题通过实验探究碱式碳酸铜的受热分解产物,属于中档题.实验猜想要有依据,不能凭空猜想,验证猜想要通过实验,依据碳和氧化铜的化学性质不同选择合适的试剂,根据实验现象不同可鉴别二者.

练习册系列答案
相关题目