题目内容
 如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是:
如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是:
(1)红磷燃烧________;
(2)打开弹簧夹________.
(3)此反应的化学方程式为________.
(4)实验时发现水面上升不到 ,可能的原因有:①________ ②________ ③________.
,可能的原因有:①________ ②________ ③________.
解:(1)红磷燃烧的现象是:产生黄色的火焰和产生大量的白烟并放热;故答案为:产生黄色的火焰和产生大量的白烟并放热;
(2)红磷燃烧消耗了空气中的氧气,使得瓶内压强减少,打开弹簧夹现象为:烧杯中的水沿导管倒流入集气瓶中,约占空气体积的五分之一;
故答案为:烧杯中的水沿导管倒流入集气瓶中,约占空气体积的五分之一;
(3)根据书写化学方程式的步骤,红磷燃烧的化学方程式为:4P+5O2 2P2O5; 故答案为:4P+5O2
2P2O5; 故答案为:4P+5O2 2P2O5;
2P2O5;
(4)若红磷的量不足,导致不能将装置内的氧气完全反应掉,因此测得氧气的体积分数小于 ;
;
若装置漏气,导致空气进入集气瓶内,因此测得的氧气的体积分数小于 ;
;
若未等到装置冷却到室温,就打开止水夹,会使集气瓶内的气体处于膨胀状态,因此测得的氧气体积分数会小于 ;.
;.
故答案为:①红磷量不足;②未等到冷却到室温就打开止水夹;③装置漏气.
分析:(1)(2)本题是测定空气中氧气的含量,我们常用燃烧红磷的方法,磷燃烧的现象是:发黄光、放热、产生大量的白烟;生成白色固体是五氧化二磷,几乎不占空间,使得内外产生气压差,产生倒吸现象,得出结论;
(3)根据书写化学方程式的步骤:写、配、注、等,正确写出方程式即可;
(4)产生误差的原因可以从装置的气密性、药品的用量、装置是否冷却等方面进行分析解答.
点评:本考点考查学生对测定空气中氧气的含量的实验现象、实验中的注意事项,及实验中的误差分析(可以从药品的用量、装置的气密性以及装置是否冷却等方面)是中考的主要考点之一.
(2)红磷燃烧消耗了空气中的氧气,使得瓶内压强减少,打开弹簧夹现象为:烧杯中的水沿导管倒流入集气瓶中,约占空气体积的五分之一;
故答案为:烧杯中的水沿导管倒流入集气瓶中,约占空气体积的五分之一;
(3)根据书写化学方程式的步骤,红磷燃烧的化学方程式为:4P+5O2
 2P2O5; 故答案为:4P+5O2
2P2O5; 故答案为:4P+5O2 2P2O5;
2P2O5;(4)若红磷的量不足,导致不能将装置内的氧气完全反应掉,因此测得氧气的体积分数小于
 ;
;若装置漏气,导致空气进入集气瓶内,因此测得的氧气的体积分数小于
 ;
;若未等到装置冷却到室温,就打开止水夹,会使集气瓶内的气体处于膨胀状态,因此测得的氧气体积分数会小于
 ;.
;.故答案为:①红磷量不足;②未等到冷却到室温就打开止水夹;③装置漏气.
分析:(1)(2)本题是测定空气中氧气的含量,我们常用燃烧红磷的方法,磷燃烧的现象是:发黄光、放热、产生大量的白烟;生成白色固体是五氧化二磷,几乎不占空间,使得内外产生气压差,产生倒吸现象,得出结论;
(3)根据书写化学方程式的步骤:写、配、注、等,正确写出方程式即可;
(4)产生误差的原因可以从装置的气密性、药品的用量、装置是否冷却等方面进行分析解答.
点评:本考点考查学生对测定空气中氧气的含量的实验现象、实验中的注意事项,及实验中的误差分析(可以从药品的用量、装置的气密性以及装置是否冷却等方面)是中考的主要考点之一.

练习册系列答案
相关题目
 21、化学课上做“用红磷燃烧测定空气中氧气的体积分数”的实验时,由于红磷燃烧生成的P2O5对人体有一定危害,小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装置如图所示.实验时用夹子B夹住橡胶管,打开夹子A,点燃纯净的氢气并迅速插入甲瓶中,使氢气在甲瓶中燃烧.
21、化学课上做“用红磷燃烧测定空气中氧气的体积分数”的实验时,由于红磷燃烧生成的P2O5对人体有一定危害,小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装置如图所示.实验时用夹子B夹住橡胶管,打开夹子A,点燃纯净的氢气并迅速插入甲瓶中,使氢气在甲瓶中燃烧.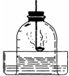 如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题:
如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题:

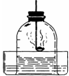 如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题:
如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题:

