题目内容
某学生利用大试管、长颈漏斗、量筒、水槽、胶塞(有孔)、玻璃导管、橡皮导管,还有秒表等器材设计一套发生H2实验装置,并用排水集气法将H2吸收于量筒中,用秒表记录反应时间,观察一定时间内产生H2的体积.请回答下列问题:
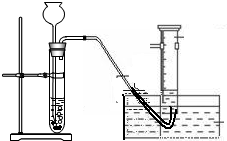
(1)画出发生和吸收H2的装置图(铁架台等不画出):______
(2)实验记录如下(注:H2的体积已折算为标准状况):
| 时间(分钟) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
 (mL) (mL) | 100 | 160 | 200 | 224 | 224 | 224 | 224 | 224 |
反应的前2分钟内,每分钟平均产生H2的体积是______mL,反应的前4分钟内每分钟产生H2的体积是______mL.
(3)已知65g锌与足量盐酸反应,能产生22.4LH2(标准状况).上述实验中加入的10g盐酸中反应后只用去一半,则反应的锌为______g,原盐酸中溶质的质量分数为______.
【答案】分析:根据表中数据求平均值,根据化学方程式已知一种反应物的质量,求另一种反应物的质量.
解答:解:(1)本题要测一定时间内产生氢气的体积,可用氢气将量筒中的水排出的方法测量氢气的体积,装置图如下.
(2)由表中数据可知前2分钟产生氢气160mL,平均每分钟产生80mL;前4分钟内产生氢气224mL,平均每分钟产生56mL;
(3)65g锌反应产生22.4L氢气,要产生224mL氢气需要锌的质量为0.65g;根据化学方程式已知锌的质量可求出盐酸的溶质质量分数.
设盐酸的溶质质量分数为x
Zn+2HCl=ZnCl2 +H2↑
65 73
0.65g 5g×x
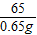 =
=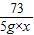
x=14.6%
故答案为:(1)
(2)80;56;
(3)0.65g;14.6%
点评:要测量氢气的体积,可转化成测量水的体积,故可将量筒内装有水,然后用氢气将水排出的方法测量氢气的体积.
解答:解:(1)本题要测一定时间内产生氢气的体积,可用氢气将量筒中的水排出的方法测量氢气的体积,装置图如下.
(2)由表中数据可知前2分钟产生氢气160mL,平均每分钟产生80mL;前4分钟内产生氢气224mL,平均每分钟产生56mL;
(3)65g锌反应产生22.4L氢气,要产生224mL氢气需要锌的质量为0.65g;根据化学方程式已知锌的质量可求出盐酸的溶质质量分数.
设盐酸的溶质质量分数为x
Zn+2HCl=ZnCl2 +H2↑
65 73
0.65g 5g×x
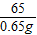 =
=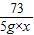
x=14.6%
故答案为:(1)

(2)80;56;
(3)0.65g;14.6%
点评:要测量氢气的体积,可转化成测量水的体积,故可将量筒内装有水,然后用氢气将水排出的方法测量氢气的体积.

练习册系列答案
相关题目
某学生利用大试管、长颈漏斗、量筒、水槽、胶塞(有孔)、玻璃导管、橡皮导管,还有秒表等器材设计一套发生H2实验装置,并用排水集气法将H2吸收于量筒中,用秒表记录反应时间,观察一定时间内产生H2的体积.
请回答下列问题:
(1)画出发生和吸收H2的装置图(铁架台等不画出):
(2)实验记录如下(注:H2的体积已折算为标准状况):
回答:
反应的前2分钟内,每分钟平均产生H2的体积是 mL,反应的前4分钟内每分钟产生H2的体积是 mL.
(3)已知65g锌与足量盐酸反应,能产生22.4LH2(标准状况).上述实验中加入的10g盐酸中反应后只用去一半,则反应的锌为 g,原盐酸中溶质的质量分数为 .
请回答下列问题:
(1)画出发生和吸收H2的装置图(铁架台等不画出):
(2)实验记录如下(注:H2的体积已折算为标准状况):
| 时间(分钟) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| VH2(mL) | 100 | 160 | 200 | 224 | 224 | 224 | 224 | 224 |
反应的前2分钟内,每分钟平均产生H2的体积是
(3)已知65g锌与足量盐酸反应,能产生22.4LH2(标准状况).上述实验中加入的10g盐酸中反应后只用去一半,则反应的锌为