题目内容
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
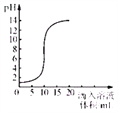
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH_____7(填“大于”或“小于”或“等于”),该反应的实质是_____。
(2)根据曲线判断,该反应是将_____(填“氢氧化钠溶液”或“盐酸”,下同)滴入_______中,理由是_____。
(3)当滴入溶液的体积为15mL时,所得溶液中的溶质为_____(写化学式),若在此溶液中滴入石蕊试液,溶液显_____色。
【答案】 等于; H++OH﹣=H2O; 盐酸 ; 氢氧化钠 ; 溶液的pH逐渐增大; NaOH、NaCl ; 蓝 。
【解析】本题是利用酸碱中和反应结合图像知识来考查,难度不大,考查的知识面较广,要求在理解中和反应的基础上,能对反应的程度结合溶液的pH进行分析。
(1)氢氧化钠和盐酸恰好完全反应时,溶液呈中性,pH=7;中和反应的实质是酸中的氢离子与碱中的氢氧根离子结合成水分子(或H++OH﹣=H2O);
(2)根据曲线判断,向盐酸中滴入氢氧化钠溶液,理由是:溶液的pH逐渐增大;
(3)盐酸和氢氧化钠的反应原理是:HCl+NaOH=NaCl+H2O,滴入氢氧化钠溶液的体积为15mL时,氢氧化钠过量,pH>7,溶液为碱性,所以是部分氢氧化钠和盐酸反应,所得溶液中的溶质化学式为:NaOH、NaCl。若在此溶液中滴入石蕊试液,溶液显蓝色。

练习册系列答案
相关题目