题目内容
金属钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,将2.3g金属钠投入97.7g水中,充分反应后,所得的溶液中溶质的质量分数( )
【答案】分析:由金属钠的质量根据化学方程式可以计算出生成氢氧化钠和氢气的质量;
氢氧化钠是所得溶液中的溶质;
用反应前的总质量去掉生成氢气的质量就是所得溶液的质量;
根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
解答:解:设生成氢氧化钠的质量为x,生成氢气的质量为y.
2Na+2H2O=2NaOH+H2↑
46 80 2
2.3g x y
 =
= =
= ,x=4g,y=0.1g
,x=4g,y=0.1g
所得溶液中溶质的质量分数为
 ×100%≈4.004%>4%
×100%≈4.004%>4%
故选D.
点评:本题主要考查有关化学方程式的计算和有关溶质质量分数的计算,难度较大.
氢氧化钠是所得溶液中的溶质;
用反应前的总质量去掉生成氢气的质量就是所得溶液的质量;
根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
解答:解:设生成氢氧化钠的质量为x,生成氢气的质量为y.
2Na+2H2O=2NaOH+H2↑
46 80 2
2.3g x y
 =
= =
= ,x=4g,y=0.1g
,x=4g,y=0.1g所得溶液中溶质的质量分数为
 ×100%≈4.004%>4%
×100%≈4.004%>4%故选D.
点评:本题主要考查有关化学方程式的计算和有关溶质质量分数的计算,难度较大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
金属钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,将2.3g金属钠投入97.7g水中,充分反应后,所得的溶液中溶质的质量分数( )
| A、等于2.3% | B、等于4% | C、小于4% | D、大于4% |
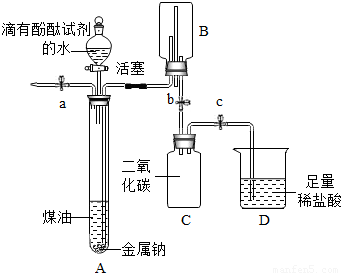 小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL.
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是______.
(2)实验过程
| 操作 | 现象及解释 | |
| ① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞. | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中.金属钠的物理性质(写出一点即可)______. |
| ② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b. | 反应的化学方程式为______ |
| ③ | 打开止水夹c. | ______溶液红色消失. 反应的化学方程式为______. |
| ④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯. | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气. |
金属钠与水反应的化学方程式为______;反应结束,C中溶液的溶质是(指示剂除外,写出所有可能)______.
 (2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
(2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.