题目内容
(30分)生活处处皆化学。
(1)生活中的燃烧
①着火点比较:蜂窝煤 小木条(填“>”、“<”或“=”)。生煤炉过程中,不断扇入空气目的是 ,煤不完全燃烧产生一种有毒气体的化学式是 ;
②用水灭火的原理是 ,新型水成膜泡沫灭火剂扑灭油类火灾时,析出的液体和泡沫在油面上铺展形成一层水膜,进而灭火,原理是 。
(2)金属在生活中用途广泛
①下列生活用品,主要是由金属材料制成的是 ;

②用铁锅烹饪食物时,会有少量铁屑在胃部转化为可被吸收的Fe2+,反应的化学方程式为 ,是 反应(填基本反应类型)。
③用铝箔包装药物,主要利用了铝的 性;
④铜具有很好的 性,故可作导线。近代湿法冶金的先驱是指 (填化学方程式),铜和空气中的O2、H2O及 会生成铜锈[Cu2(OH)2CO3],反应的化学方程式是 。
(3)生活中的水和溶液
①处理自然水时,常用的混凝剂是 (填名称)。二氧化氯是一种新型的消毒剂,其化学式为 ;
②欲配制500mL 0.9%的生理盐水(密度为1.0 g/mL),需要NaCl的质量为 g;配制过程中,玻璃棒的作用是 ,称量NaCl时,若将砝码放在左盘(1 g以下用游码),其他操作均正确,则所配溶液中溶质质量分数将 0.9%(填“>”、“<”或“=”)
③右图是净化河水的简易装置,下列说法正确的是 ;

A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
a.从上表可总结出KNO3的溶解度随温度变化的趋势是 ;
b.20℃时,将20gKNO3加入50g水中充分溶解,所得溶液的质量为 g;
c.现有60℃时的KNO3饱和溶液210 g,降温至20℃,会析出KNO3 g;
(4)食品包装学问大
①我区特产——嘶马羊耳采用真空包装,延长了食品的保质期,原理是 ;
②将N2充入包装袋内做保护气,是因为N2的化学性质 (填“活泼”或“稳定”);
③右图是“504双吸剂”的标签,请问答下列问题:

a.其中至少含有 种单质;
b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是 。通入CO2后,上层清液变浑浊,写出上述变化的化学方程式 、 ;
c.为测定此双吸剂的使用效果,取足量双吸剂做了如右图所示的实验,一段时间后,进入试管中水的体积 21%(填“>”、“<”或“=”),理由是 ;
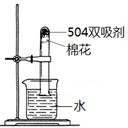
d.部分失效的双吸剂中,有红棕色固体,其主要是 ;
e.此双吸剂中,NaCl的作用可能是 。
(1)①> 充分燃烧(或与氧气充分接触) CO
②水蒸发吸热,使温度降低到着火点以下(或降温) 隔绝氧气
(2)①AC ②Fe + 2HCl ="=" FeCl2 + H2↑ 置换 ③延展性
④导电 Fe + CuSO4 ="=" FeSO4 + Cu CO2 2Cu + O2 + H2O + CO2 ="=" Cu2(OH)2CO3
(3)①明矾 ClO2 ②4.5 搅拌,加快溶解 < ③D
④随温度升高而增加 65.8 78.4
(4)①隔绝氧气,杜绝缓慢氧化(其他合理答案也可) ②稳定
③a.2
b.用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数(写出主要操作方法即可)
H2O + CaO ="=" Ca(OH)2 Ca(OH)2 + CO2 ="=" CaCO3↓ + H2O
c.> 此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O(必须回答到O2和CO2,否则不得分)
d.氧化铁(或Fe2O3) e.加快双吸剂中铁粉吸收O2的速率(或加快铁锈蚀的速率)
【解析】
试题分析:(1)①着火点比较:蜂窝煤>小木条。生煤炉过程中,不断扇入空气目的是充分燃烧(或与氧气充分接触),煤不完全燃烧产生一种有毒气体的化学式是CO;
②用水灭火的原理是水蒸发吸热,使温度降低到着火点以下,新型水成膜泡沫灭火剂扑灭油类火灾时,析出的液体和泡沫在油面上铺展形成一层水膜,进而灭火,原理是隔绝氧气;
(2)①铁锅和硬币主要是由金属材料制成的;
②少量铁屑在胃部转化为可被吸收的Fe2+,反应的化学方程式为Fe + 2HCl = FeCl2 + H2↑,是置换反应;
③用铝箔包装药物,主要利用了铝的延展性,可以制成铝箔;
④铜具有很好的导电性,故可作导线。近代湿法冶金的先驱是指Fe + CuSO4 ="=" FeSO4 + Cu,铜和空气中的O2、H2O及CO2反应会生成铜锈[Cu2(OH)2CO3],反应的化学方程式是2Cu + O2 + H2O + CO2 ="=" Cu2(OH)2CO3;
(3)①处理自然水时,常用的混凝剂是明矾。二氧化氯是一种新型的消毒剂,其化学式为ClO2;
②欲配制500mL 0.9%的生理盐水(密度为1.0 g/mL),需要NaCl的质量为500×1.0×0.9%=4.5g;配制过程中,玻璃棒的作用是搅拌,称量NaCl时,若将砝码放在左盘(1 g以下用游码),其他操作均正确,则所配溶液中溶质质量分数将<0.9%;
③用上图简易装置净化河水,通过过滤可以除去水中的固体不溶物,利用活性炭的吸附性,可以除去水中的色素及异味,不能将硬水软化,更得不到纯净水,选D。
④由表中数据可知:
a. KNO3的溶解度随温度变化的趋势是随温度升高而增加;
b.20℃时,KNO3的溶解度是31.6g,故20℃时,50g水中最多溶解KNO3的质量是15.8g;故20℃时,将20gKNO3加入50g水中充分溶解,所得溶液的质量为50+15.8=65.8g;
c.60℃时的KNO3的溶解度是110g,即60℃时,210 g KNO3饱和溶液中含有110g KNO3,20℃时,KNO3的溶解度是31.6g,故降温至20℃,会析出KNO3 110-31.6=78.4g;
(4)①真空包装可以延长了食品的保质期,原理是隔绝氧气,杜绝缓慢氧化;
②将N2充入包装袋内做保护气,是因为N2的化学性质稳定;
③由“504双吸剂”的标签可知:
a.其中至少含有两种单质;
b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数。
加水并通入CO2后,上层清液变浑浊,变化的化学方程式H2O + CaO ="=" Ca(OH)2、Ca(OH)2 + CO2 ="=" CaCO3↓ + H2O;
c.为测定此双吸剂的使用效果,取足量双吸剂做题中图示的实验,一段时间后,进入试管中水的体积>21%,理由是此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O;
d.部分失效的双吸剂中,有红棕色固体,这是铁粉反应的结果,其主要是氧化铁(或Fe2O3);
e.此双吸剂中,NaCl的作用可能是加快双吸剂中铁粉吸收O2的速率(或加快铁锈蚀的速率)
考点:燃烧的条件;灭火的方法;化学方程式;金属的性质;水的净化;溶解度;空气的组成;溶液的PH。
点评:本题考查的内容较多,涉及的面较广,但难度不大,仔细阅读题目,看清题意即可。

 29、小丽发现昨天切过青菜的菜刀今天早晨就锈迹斑斑,请参与讨论:(每空1分计13分)
29、小丽发现昨天切过青菜的菜刀今天早晨就锈迹斑斑,请参与讨论:(每空1分计13分)